
Предисловие
Данное методическое руководство представляет собой пособие для практических занятий по дисциплине «Физическая химия», предназначенное для студентов технологических специальностей. Пособие ставит перед собою цель познакомить студентов с методами и приемами расчетов по основным разделам физической химии: «Основы химической термодинамики», «Термодинамика химического равновесия» и «Фазовые равновесия», изучение которых является важнейшей практической задачей физической химии.
Руководство состоит из пяти тем и включает 22 задачи, для каждой из которых предусмотрено 30 вариантов индивидуальных заданий. Задачи направлены на развитие научной интуиции, воображения и способствуют более глубокому пониманию предмета. В каждой теме кратко излагаются основные физико-химические понятия и законы, приведены необходимые для решения уравнения. Для каждой задачи дан пример с подробным решением.
Руководство построено таким образом, что решение предыдущего задания является частью решения последующего, т.е. задания представлены в логичной последовательности и иллюстрируют связь полученных физико-химических результатов с фундаментальными законами химической термодинамики.
Материал каждой темы представлен в следующей последовательности:
1) условие задач;
2) пример решения задач;
3) многовариантные задачи для самостоятельного решения;
4) контрольные вопросы.
Такая форма изложения является оптимальной для проведения практических занятий по физической химии и должна помочь студентам освоить основные термохимические расчеты.
Тема 1. Расчет теплот физических и химических превращений
Задача №1
Вещество А (табл.1) в количестве m г находится при T = 25 ºС и давлении p1 = 1,013 ·105 Па. Определить теплоту Q, работу A, изменение внутренней энергии U и изменение энтальпии H: а) при изотермическом расширении до объема V2 м3; б) при изобарном расширении до того же объема; в) при изохорном нагревании до достижения давления p2 Па; г) при адиабатическом сжатии до p2 Па. Принять, что вещество А подчиняется законам идеальных газов. Истинную мольную теплоемкость вещества взять из справочника.
Таблица 1
Вариант |
А |
m, г |
V2, м3 |
p2∙10–5, Па |
1 |
2 |
3 |
4 |
5 |
1 |
Br2 |
500 |
0,5 |
1,30 |
2 |
СО2 |
200 |
0,25 |
1,97 |
3 |
N2 |
150 |
0,30 |
1,93 |
4 |
Р4О10 |
100 |
0,12 |
1,95 |
5 |
SО2 |
350 |
0,23 |
1,5 |
6 |
Cl2 |
500 |
0,12 |
1,97 |
7 |
BCl3 |
200 |
0,25 |
1,92 |
8 |
BF3 |
200 |
0,10 |
1,40 |
9 |
COCl2 |
120 |
0,28 |
1,99 |
10 |
COS |
150 |
0,32 |
1,92 |
11 |
O2 |
180 |
0,32 |
1,91 |
12 |
NOCl |
110 |
0,40 |
1,96 |
13 |
NO2 |
120 |
0,21 |
1,97 |
14 |
N2O |
190 |
0,26 |
1,92 |
15 |
N2O4 |
155 |
0,28 |
1,91 |
16 |
N2O5 |
135 |
0,21 |
1,93 |
17 |
PCl3 |
138 |
0,28 |
1,50 |
18 |
PCl5 |
140 |
0,25 |
1,92 |
Продолжение таблицы1
1 |
2 |
3 |
4 |
5 |
19 |
H2 |
145 |
0,20 |
1,96 |
20 |
SO3 |
155 |
0,16 |
1,91 |
21 |
SbCl3 |
160 |
0,18 |
1,90 |
22 |
SiCl4 |
165 |
0,19 |
1,93 |
23 |
SiCF4 |
170 |
0,24 |
1,91 |
24 |
SiH4 |
175 |
0,32 |
1,97 |
25 |
HJ |
350 |
0,36 |
1,60 |
26 |
HF |
380 |
0,42 |
1,92 |
27 |
HBr |
440 |
0,51 |
1,96 |
28 |
HCl |
480 |
0,52 |
1,91 |
29 |
HCN |
510 |
0,38 |
1,85 |
30 |
ClO2 |
600 |
0,61 |
1,75 |
Решение:
Для двуокиси углерода CO2 в количестве 100 г, находящейся при температуре T = 0 ºС и давлении p = 1,013 ·105 Па, определим Q, A, U и H: а) при изотермическом расширении до объема 0,2 м3; б) при изобарном расширении до того же объема; в) при изохорном нагревании до достижения давления 2,026 ·105 Па; г) при адиабатическом сжатии до 2,026 ·105 Па.
Математическое выражение I-го закона термодинамики для процессов, связанных с бесконечно малыми изменениями состояния системы, имеет вид
![]() ,
(1)
,
(1)
где Q – теплота; U – внутренняя энергия; A – работа.
Функции, которые однозначно определяют состояние системы, называют функциями состояния. Внутренняя энергия U, а также энтальпия H, которая выражается уравнением
![]() ,
(2)
,
(2)
являются функциями состояния. Теплота Q и работа A служат формами передачи энергии и связаны с процессом, а не с состоянием системы, т.е. являются функциями процесса.
В двух частных случаях теплота и работа приобретают свойства функций состояния (закон Гесса):
![]() ;
(V
= const, T
= const) (3)
;
(V
= const, T
= const) (3)
![]() .
(p
=
const, T
= const) (4)
.
(p
=
const, T
= const) (4)
В интегральной форме математическое выражение I-го закона термодинамики имеет вид
![]() .
(5)
.
(5)
Для решения задачи примем, что CO2 подчиняется законам идеальных газов, а истинная мольная теплоемкость CO2 при постоянном давлении постоянна и равна 37,1 Дж/моль·К.
а) для изотермического расширения
∆U = 0 и ∆H = 0, следовательно Q = A.
Если из всех внешних сил на систему действует только внешнее давление p, то при переходе системы из состояния 1 в состояние 2 работу расширения можно вычислить по уравнению
![]() .
(6)
.
(6)
Для изотермического процесса
![]() .
(7)
.
(7)
Определим число молей CO2 по формуле
![]() .
(8)
.
(8)
Число молей CO2 в 100 г составляет n = 100/44 = 2,27 моль.
Первоначальный объем определяем из уравнения Клапейрона – Менделеева
![]() ,
(9)
,
(9)
![]() = 2,27·8,314·273/1,013·105
= 0,0509 м3.
= 2,27·8,314·273/1,013·105
= 0,0509 м3.
Количество теплоты и работы определяем по уравнению (7)
Q = A = 2,3·2,27·8,314·273 lg (0,2/0,0509) = 7070 Дж = 7,07 кДж.
б) для изобарного процесса
![]() .
(10)
.
(10)
Отсюда Qp = ∆H = 2,27·37,1·273/0,0509 (0,2 – 0,0509) = 67400 Дж =
= 67,4 кДж.
Работа расширения газа в изобарных условиях
![]() ,
(11)
,
(11)
A = 1,013·105 (0,2 – 0,0509) = 15000 Дж = 15,0 кДж.
Из
уравнения (5)
![]() = 67,4 – 15,0 = 52,4 кДж.
= 67,4 – 15,0 = 52,4 кДж.
в) для изохорного процесса
![]() .
(12)
.
(12)
Выражение для взаимосвязи мольной теплоемкости идеальных газов при постоянном давлении Сp и при постоянном объеме CV имеет вид
![]() .
(13)
.
(13)
Теплоемкость при постоянном объеме
CV = Cp – R = 37,1 – 8,31 = 28,8 Дж/моль·К.
QV = ∆U = 2,27·28,8·273/1,013·105 (2,026 ·105 – 1,013·105) = 17900 Дж = = 17,9 кДж.
Из уравнения (2) для изохорного процесса имеем:
![]() .
.
Отсюда
∆H = 17,9 + 0,0509 (2,026 – 1,013) · 105 = 23100 Дж = 23,1 кДж.
г) для адиабатического сжатия
Q = 0 и A = – ∆U
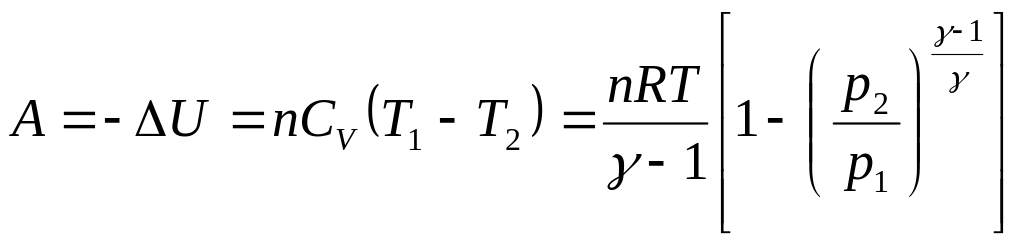 ,
(14)
,
(14)
где
![]() = 37,1/28,8 = 1,29.
= 37,1/28,8 = 1,29.
![]() = – 970 Дж = – 2,97кДж.
= – 970 Дж = – 2,97кДж.
Из уравнения (2) для адиабатического процесса
![]() .
.
Выражая
конечный объем V2
из
уравнения адиабаты
![]() ,
получим
,
получим
 ,
(15)
,
(15)
![]() =
3830 Дж = 3,83кДж.
=
3830 Дж = 3,83кДж.
