
- •Основные положения
- •Радиоактивность. Ядерные реакции.
- •1. Биография
- •2. Открытие периодического закона и его роль
- •2.1 Предпосылки
- •2.2 Открытие периодического закона
- •2.3 Периодический закон и строение атома
- •2.4 Периодическая система химических элементов и строение атома
- •2.5 Роль открытия
- •3. Работы в области органической химии
- •4. Изучение природных богатств страны
- •5. Гидратная теория растворов
- •6. Ученый – борец за передовую науку
- •1. Реакции соединения
- •2. Реакции разложения
- •3. Реакции замещения
- •4. Реакции обмена
- •1. Протолитические реакции.
- •2. Окислительно-восстановительные реакции.
- •3. Лиганднообменные реакции.
- •4. Реакции атомно-молекулярного обмена.
- •Важнейшие восстановители
- •Определение
- •[Править]Связь с термодинамической устойчивостью системы
- •[Править]Применение в химии [править]Связь с химическим потенциалом
- •[Править]Энергия Гиббса и направление протекания реакции
- •Смещение химического равновесия
- •Образование связи
- •Образование связи при рекомбинации атомов
- •]Образование связи по донорно-акцепторному механизму
- •[Править]Виды ковалентной связи
- •[Править]σ-связь и π-связь
- •]Примеры веществ с ковалентной связью
- •[Свойства металлов [Характерные свойства металлов
- •Физические свойства металлов
- •Некоторые свойства элементов 7 группы
- •Структура
- •Кристаллические полупроводниковые материалы
- •]Некристаллические полупроводниковые материалы
- •Основные электрофизические свойства
- •Получение
- •]Легирование
- •Структурные дефекты
- •]Применение
Атомно-молекулярное учение
Атомно-молекулярное учение — совокупность законов и аксиом, описывающих все вещества как набор молекул, состоящих из атомов. Атомно-молекулярное учение обосновал и развилрусский ученый М.В.Ломоносов (корпускулярно-кинетическая теория).
История
Представление о том, что материя состоит из отдельных частиц — атомов возникло еще в древней Греции. Атомизм был создан представителями древнегреческой философии Левкиппом и его учеником Демокритом Абдерским. Однако создание научной теории стало возможно только в XVIII-XIX веках, когда физика стала базироваться на точных экспериментальных данных. В химиюколичественные методы исследований были введены М.В.Ломоносовым
Основные положения
Атомно-молекулярное теория базируется на следующих законах и утверждениях:
Все вещества состоят из атомов
Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества)
При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества

Закон сохранения массы — масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
Закон постоянства состава (закон кратных отношений) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами
Радиоактивность. Ядерные реакции.
радиоактивность - самопроизвольое превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер.
Основные виды радиоактивного распада: α-распад - ядро атома испускает два протонаи два нейтрона, связанные в ядро атома гелия 42H; этот распад приводит к уменьшению заряда исходного радиоактивного ядра на 2, а его массового цисла на 4.
β-распад - один из нейтронов, входящих в состав ядра, превращается в протон; возникающий при этом электрон вылетает из ядра, положительный заряд которого возрастает на единицу. Возможно также превращение протона в нейтрон, сопровождающееся возникновением позитрона (позитрон - элементарная частица с массой равной массе электрона, но несущая положительный заряд, по абсолютной величине заряд позитрона равен заряду электрона). Отсюда различают два вида β-распада: 1. электронный β-распад (β--распад)
нейтрон → протон + электрон (+ нейтрино + антинейтрино - не записывают в радиоактивных превращений) n → p + e-
2. позитронный β-распад (β+-распад)
протон → нейтрон + позитрон p → n + e+
Таким образом, в результате β-распада образуется атом элемента, заряд которого либо больше на единицу (в случае β--распада) либо меньше на единицу (в случае β+-распада).
Процесс превращения протона в нейтрон с образованием позитрона может происходить в тех случаях, когда неустойчивость ядра вызвана избыточным содержанием в нем протонов. При этом, один из протонов, входящих в состав ядра, превращается в нейтрон - заряд ядра уменьшается на единицу.
Электронный захват - вид радиоактивного распада, при котором один из электронов атомной электронной оболочки захватывается ядром; взаимодействие захваченного электрона с одним из содержащихся в эдре протонов приводит к образованию нейтрона:
e- + p → n
Электрон чаще всего захватывается из ближайшего к ядру K-слоя (K-захват), реже из L- или M-слоев электронной оболочки.
Спонтанное деление - вид радиоактивного распада, при котором происходит самопроизвольный распад ядер тяжелых элементов на два (иногда три или четыре) ядра элементов середины Периодической системы химических элементов. Варианты такого деления очень разнообразны и не имеют общих правил смещения по периодической системе; чаще всего происходит распад исходного ядра на тяжелый и легкий осколки, несущие, соответственно, около 60 и 40 процентов заряда и массы исходного ядра. При спонтанном делении распадающееся ядро испускает 2-4 нейтрона; образующиеся новые ядра все еще содержат избыток нейтронов (являются изотопами своих элементов), оказываются неустойчивыми и поэтому претерпевают последовательный ряд β--распадов.
Химические элементы расположенные в конце Периодической системы (после висмута), не имеют стабильных изотопов. подвергаясь радиоактивному распаду, они превращаются в другие элементы. Если вновь образовавшийся элемент радиоактивен, он тоже распадается, превращаясь в третий элемент, и так далее до тех пор, пока результатом распада не будет атом устойчивого изотопа. Ряд элементов, образующихся подобным образом, один из другого, называется радиоактивным рядом. Например,радиоактивный ряд урана:
238U → (α; Т½ = 4.5·109 лет) → 234Th → (β-; Т½ = 24 суток) → 234Pa → (β-; Т½ = 1.2 минуты) → 234U → (α; Т½ = 2.5·105 лет) → 230Th → (α; Т½ = 8·104 лет) → 226Ra → (α; Т½ = 1620 лет) → 222Rn → (α; Т½ = 3.85 суток) → 218Po → (α; Т½ = 3.05 минуты) → 214Pb → (β-; Т½ = 27 минут) → 214Bi → (α; Т½ = 20 минут) → 214Po → (α; Т½ = 6·10-4 c) → 210Pb → (β-; Т½ = 19 лет) → 210Bi → (β-; Т½ = 5 cуток) → 210Po → (α; Т½ = 138 cуток) → 206Pb (устойчив)
При β-распаде массовое число изотопа не меняется, а при α-распаде уменьшается на 4. Поэтому возможно существование 4 радиоактивных рядов: - один из них включает изотопы, массовые числа которых выражаются общей формулой 4n (n - целое число) - ряд тория 232Th → 208Pb; - второму отвечает общая формула массового числа 4n + 1 - ряд нептуния 237Np (получен искусственно) → 209Bi; - третьему - 4n + 2 - это и есть радиоактивный ряд урана); - четвертому 4n + 3 - ряд актиния, начинающийся с 235U → 207Pb.
Свинцовый метод определения возраста. Накопление свинца в результате распада содержащихся в минералах радиоактивных элементов позволяет определять возраст соответствующих горных пород. Зная скорость распада 238U, 232Th, 235U и определив их содержание, а также содержание и изотопный состав свинца в минерале, можно вычислить возраст минерала, т.е. время, прошедшее с момента его образования. Гелиевый метод определения возраста. Пригоден для минералов с протной кристаллической упаковкой, хорошо сохраняющей содержащиеся в кристаллах газы, возраст радиоактивного минерала устанавливается по количеству гелия образовавшегося в нем в результате радиоактивных превращений. Радиоуглеродный метод определения возраста. Прогоден для сравнительно молодых образований (до 70000 лет). Метод основан на радиоактивном распаде изотопа углерода-14, период полураспада которого равен 5600 лет. Этот изотоп образуется в атмосфере под действием космического излучения и усваивается организмами, после гибели которых его содержание убывает по закону радиоактивного распада. Радиоактивность содержащегося в ископаемых останках углерода, сравнивают с радиоактивностью углерода в атмосфере и рассчитывают геологический возраст.
Искусственная радиоактивность. Была обнаружена в 1933 г. Ирен Кюри и Фредерик Жолио-Кюри. Первая искуственная ядерная реакция была осуществлена в 1919 г. Резерфордом. Воздействуя на атомы азота потоком альфа-частиц, ему удалось осуществить следующий процесс:
17N + 4He → 17O + p
Для осуществления ядерной реакции, бомбардирующая частица должна обладать большой энергией, которая достигается путем разгона цастицы в ускорителях элементарных частиц (циклотроны, синхрофазотроны и др.). В настоящее время получены сотни радиоактивных изотопов химических элементов, а также новые химические элементы, которыми пополняется Периодическая система. Раздел химии, изучающий радиоактивные элементы и их поведение, называется радиохимией (существует ещерадиационная химия - этот раздел химии изучает влияние ионизирующих излучений на химические процессы).
Первая ядерная реакция , которую применили для получения энергии, представляет собой деление ядра урана 235U под действием проникающего в ядро нейтрона. При этом образуется два новых ядра-осколка блисзкой массы, испускается несколько нейтронов - это вторичные нейтроны, и освобождается огромная энергия: при распаде 1 г.235U выделяется 7,5·107 кДж, это количество энергии больше, чем выделяется при сгорании 2 тонн каменного угля. Вторичные нейтроны могут захватываться другими ядрами235U, и в свою очередь вызывать их деление. Таким образом, число отдельных актов распада прогрессивно увеличивается, возникает цепная реакция деления ядер урана -цепная ядерная реакция. Не все вторичные нейтроны участвуют в развитии этого цепного процесса: некоторые из них успевают вылететь за пределы куска урана, на успев столкнуться с ядром способного к делению изотопа. Поэтому в небольшом куске урана, начавшаяся цепная реакция может оборваться. Для ее непрерывного продолжения, масса куска урана должна быть достаточно велика, такая масса радиоактивного вещества, при которой возникающая ядерная цепная реакция приобретает непрерывный характер, называется - критическая масса радиоактивного вещества. Неконтролируемая цепная ядерная реакция, может приобрести характер взрыва, что и происходит при взрыве атомной бомбы. Для получения управляемой ядерной реакции деления необходимо регулировать скорость процесса, путем контроля над количеством нейтронов принимающих участие в ядерной реакции. Контроль количества нейтронов, осуществляется путем введения в реактор специальных стержней, изготовленных из материалов интенсивно поглощающих нейтроны (например, кадмий).
Ракции ядерного синтеза, также являются источником огромного количества энергии. Так, при образовании ядра атома гелия из ядер дейтерия и трития:
2H + 3H → 4He + n
на каждый грамм реакционной смеси выделяется 35·107 кДж, что почти в 5 раз больше, чем при распаде 1 г урана-235. Для проведения таких реакций ядерного синтеза, необходима температура прядка 1 миллиона градусов по цельсию, поэтому такие реакции ядерного синтеза получили название - реакции термоядерного синтеза или просто термоядерная реакция. В связи с технологической сложностью получения такой высокой температуры, необходимой для инициации термоядерной реакции, пока удалось осуществить только неуправляемую термоядерную реакцию (водородная бомба), и единичные примеры лабораторных экспериментов на ускорителях заряженных частиц.
Радиация - ионизирующее излучение. Ионизирующие излучения - это различные виды микрочастиц и физических полей, способные ионизировать вещество. Существуют два типа ионизирующего излучения:
Коротковолновое электромагнитное излучение
рентгеновское излучение
гамма-излучение
Потоки частиц
альфа-частиц
бета-частиц
протонов, мюонов, других ионов
другие ядра частицы-осколки возникающие от деления ядер
Источники ионизирующего излучения бывают:
Природные
радиоактивный распад радионуклидов
термоядерные реакции на Солнце
индуцированные ядерные реакции возникающие в результате попадания в ядро высокоэнергетичных элементарных частиц при распаде ядер
космические лучи
Искусственные
искусственные радионуклиды
ядерные реакторы и испытания ядерного оружия
ускорители элементарных частиц
Рентгеновский аппарат
Бытовые дозиметры измеряют ионизацию за определенное время - её мощность. Единица измерения — микроРентген в час. Именно этот показатель наиболее важен для человека, так как позволяет оценить опасность того или иного источника радиации. 1 рентген — доза фотонного излучения, образующего ионы, несущие 1 ед. заряда СГСЭ ((1/3)·10-9 кулон) в 1 см3 воздуха при нормальном атмосферном давлении и 0°C. В воздухе в 1см3 образуется 2,08·109 пар ионов. Зиверт (обозначение: Зв, Sv) — единица измерения СИ эффективной и эквивалентной доз ионизирующего излучения (используется с 1979 г.). 1 Зв = 1 Дж / кг Грей (обозначение: Гр, Gy) — единица измерения поглощённой дозы ионизирующего излучения в системе СИ. Поглощённая доза равна одному грею, если в результате поглощения ионизирующего излучения вещество получило один джоуль энергии в расчёте на один килограмм массы. 1Гр = 1Дж / кг 1 рентген/час = 1 Зв
Источник: www.Mendelev.ru
Bозможные валентности атомов
ВАЛЕНТНОСТЬ (от лат. valentia - сила) - способность атомов образовывать химические связи. В. можно рассматривать как способность атома отдавать или присоединять определ. число электронов. В. положительна, если атом отдаёт электроны, и отрицательна, если атом их присоединяет. Количественной мерой В. принято считать число валентных штрихов в структурной ф-ле молекулы, соединяющих данный атом с др. атомами молекулы (число штрихов равно кратности химической связи).
Полная картина строения молекул разных классов и хим. связей в них крайне сложна и многообразна, поэтому единого и всеобъемлющего определения В. нет. Однако в подавляющем большинстве случаев можно ограничиться рассмотрением двух типов В. - ковалентности и ионной В. (последнюю наз. также электровалентностью или гетеровалентностью). Ковалентность равна сумме кратностей ковалентных связей, образованных данным атомом, т. е. связей, возникающих за счёт обобществления пар электронов (в случае одинарной связи это одна пара, в случае двойной связи - две пары и т. п.). Ионная В. определяется числом электронов, к-рое данный атом отдал или получил при образовании ионной связи. В нек-рых случаях под В. понимают координац. число, равное числу атомов, находящихся в непосредств. близости с данным атомом в молекуле, комплексном соединении или кристалле.
В. атома связана с его электронной структурой, а следовательно, и с его положением в периодической системе элементов, т, к., отдавая или присоединяя электроны, атом стремится иметь заполненную, наиб. устойчивую внеш. электронную оболочку. Так, макс. В. атома С, имеющего во внешней (валентной) оболочке 4 электрона, равна 4, поэтому, напр., в молекуле метана (CH4) он связан ковалентными связями с 4 атомами водорода, его ковалентность равна 4. Атом Na отдаёт единств. внеш. электрон (валентность Na+1) атому F, имеющему во внеш. оболочке 7 электронов (валентность F -1), в результате чего образуется молекула NaF. T. о., можно заключить, что атомы щелочных металлов имеют валентность +1, атомы щёлочноземельных элементов - валентность +2, атомы галогенов - валентность -1, атом N, имеющий на внеш. оболочке 5 электронов, должен быть трёхвалентным, а атом О, имеющий 6 внеш. электронов,- двухвалентным.
Исторически понятие В. сложилось на основе сформулированного в нач. 19 в. Дж. Дальтоном (J. Dalton) закона кратных отношений. В сер. 19 в. стало известно, что допустимы далеко не все возможные кратные отношения; напр., атом F способен соединиться лишь с одним атомом H, атом О - с двумя, атом N - с тремя, атом С - с четырьмя атомами H. Эта способность связывать или замещать определ. кол-во атомов и была названа В. После возникновения первой теории атома Г. Льюис (G. Lewis) в 1916-17 сформулировал правило, по к-рому каждый элемент стремится иметь в разл. соединениях заполненную внеш. электронную оболочку, и теоретически обосновал ковалентность, а В. Кос-сель (W. Kossel) дал теорию ионной В. Понятие В. приобрело новое содержание, к-рое затем существенно обогатилось и усложнилось благодаря развитию квантовой химии и синтезу соединений, обладающих необычными свойствами.
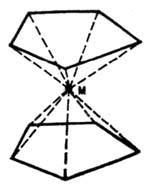
В квантовой
химии широкое
распространение получило понятие
направленной В. Так, считается, что у
атома С, имеющего координац. число 4 (4
ближайших соседа, с к-рыми данный атом
образует ковалентные связи), В. направлены
в вершины тетраэдра (при условии, что
сам атом находится в центре тетраэдра);
у атома С с координац. числом 3 (одна из
ковалентных связей является двойной)
В. лежат в одной плоскости и образуют
между собой углы 120° и т.д. В ![]() -комплексах
типа приведённых на рис., где M - атом Fe,
Cr, Ti и т. п. связан с двумя пентадиенильными
циклами C5H5,
В. направлены от атома металла к атомам,
образующим пента-диенильные циклы. Для
таких комплексов возникли представления
о делокализованной В. (поскольку
-комплексах
типа приведённых на рис., где M - атом Fe,
Cr, Ti и т. п. связан с двумя пентадиенильными
циклами C5H5,
В. направлены от атома металла к атомам,
образующим пента-диенильные циклы. Для
таких комплексов возникли представления
о делокализованной В. (поскольку ![]() -электроны
в таких кольцах делокализованы по всему
циклу -"обобществлены") и групповой
В. (поскольку речь идёт о взаимодействии
атома металла с группой атомов).
-электроны
в таких кольцах делокализованы по всему
циклу -"обобществлены") и групповой
В. (поскольку речь идёт о взаимодействии
атома металла с группой атомов).
В
настоящее время синтезированы соединения
инертных газов (XeF2,
XeF4,
XeO3 и
пр.), В. к-рых считалась равной нулю.
Наконец, обнаружено очень большое число
соединений, в к-рых один и тот же атом
соединяется с атомами др. элемента в
разл. стехиометрич. соотношениях,
зависящих от внеш. условий. Так,
газообразное соединение PCl5,
конденсируясь, даёт комплексы [PCl4]+ и
[PCl6]
~ с координац. числами 4 и 6 соответственно.
При повышении темп-ры образуются
соединения PCl3,
PCl2,
PCl и ионы ![]() и
т. д. Более того, оказалось, что проявлять
"переменную" В. может подавляющее
большинство элементов, образуя ряд
валентно-ненасыщенных соединений с В.
от 1 до нек-рого макс. значения.
и
т. д. Более того, оказалось, что проявлять
"переменную" В. может подавляющее
большинство элементов, образуя ряд
валентно-ненасыщенных соединений с В.
от 1 до нек-рого макс. значения.
T. о., строго говоря, В. не является специфич. характеристикой элемента; можно говорить лишь о склонности элемента проявлять в раал. хим. соединениях ту или иную В.
С понятием В. тесно связано понятие валентного состояния атома, т. е. такого гипотетич. состояния, в к-ром атом находится в молекуле. Это состояние определяется типом и числом занятых и вакантных валентных атомных орбиталей (т. е. таких, к-рые соответствуют внеш. электронным оболочкам), числом электронов, заселяющих каждую атомную орбиталь, и относит. ориентацией спинов электронов. Очевидно, в рассмотренном выше ряду соединений, состоящих из P и Cl, валентное состояние атома P меняется от соединения к соединению.
Источник: www.Himiy.ru
Значения периодического закона
Периодический закон и Периодическая система химических элементов Д.И. Менделеева – основа современной химии. Да и остальные открытия ученого по сей день не потеряли своего значения.
Дмитрий Иванович Менделеев – один из самых выдающихся ученых. Его исследования, открытия, изыскания оказали огромное влияние на развитие многих наук (химии, в частности) и образования. Д.И. Менделеев обладал всеми качествами талантливого ученого: даром научного предвидения, научной интуицией, умением обобщать, анализировать, делать верные выводы, постоянным стремлением к познанию неведомого. И что самое главное: ученый не считал науку обособленной. Д.И. Менделеев полагал, что научные открытия, в первую очередь, должны иметь практическое значение.
Именем ученого названы города, заводы, учебные заведения, научно-исследовательские институты. В честь Д.И. Менделеева в России утверждена золотая медаль – она присуждается за выдающиеся работы по химии. Имя ученого присвоено Российскому химическому обществу. Даже элементу с порядковым номером 101 было дано название менделевий, в честь Дмитрия Ивановича.
Научное и педагогическое наследие Д.И. Менделеева огромно – полное собрание сочинений составляет 25 томов! Круг интересов ученого был весьма разнообразен, его интересовали порой совершенно противоположные отрасли знания.
Человек, считающий себя образованным, просто обязан знать, какой ценный вклад внес в российскую (да и в мировую) науку такой редчайший гений, как Д.И. Менделеев.
