
Билет 6
Вопрос 1:
Титр раствора (от фр. titre — качество, характеристика) — способ выражения концентрации, применяемый, в основном, в аналитической химии. Обозначается заглавной латинской буквой T (тэ). Измеряется в г/мл (г/см³).( Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ; имеет целью определение элементов или групп элементов, входящих в состав различных веществ)
Различают титр по растворённому веществу и титр по определяемому веществу (условный титр).
Титр по растворённому веществу или просто титр — масса растворённого вещества (в граммах), содержащаяся в одном миллилитре (см³) раствора.
Рассчитывается по формуле:
![]()
где
![]() —
титр
раствора (в г/мл)
—
титр
раствора (в г/мл)
![]() —
масса
растворённого вещества (в г)
—
масса
растворённого вещества (в г)
![]() —
объём
раствора (в мл)
—
объём
раствора (в мл)
Титр по определяемому веществу или условный титр — масса какого-либо вещества (в граммах), реагирующая с одним миллилитром данного раствора. Иными словами: масса определяемого вещества,оттитровываемая одним миллилитром раствора.
Рассчитывается по формуле:
![]()
где
![]() —
титр
раствора вещества A по веществу B (в г/мл)
—
титр
раствора вещества A по веществу B (в г/мл)
![]() —
масса
вещества B, взаимодействующего с данным
раствором (в г)
—
масса
вещества B, взаимодействующего с данным
раствором (в г)
![]() —
объём
раствора вещества A (в мл)
—
объём
раствора вещества A (в мл)
Условный титр и титр по растворённому веществу связаны следующей формулой:
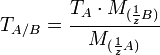
где
![]() и
и ![]() — молярные
массы эквивалентов веществ
A и B соответственно.
— молярные
массы эквивалентов веществ
A и B соответственно.
Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях.
Например, рассмотрим следующую реакцию:
H3PO4 + 2KOH K2HPO4 + 2H2O.
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом H3PO4 будет являться условная частица 1/2H3PO4, т.к. если одна молекула H3PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы H3PO4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества, эквивалентное одному моль катионов водорода в рассматриваемой реакции.
Фактор эквивалентности Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности. Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1.
fЭ (формульная единица вещества) эквивалент |
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH K3PO4 + 3H2O fЭ(H3PO4) = 1/3
H3PO4 + KOH KН2PO4 + H2O fЭ(H3PO4) = 1.
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Эквивалентная молярная масса вещества
Молярная
масса эквивалентов
обычно обозначается как ![]() или
или ![]() .
Отношение эквивалентной молярной массы
вещества к его собственно молярной
массе называется фактором
эквивалентности (обозначается
обычно как
.
Отношение эквивалентной молярной массы
вещества к его собственно молярной
массе называется фактором
эквивалентности (обозначается
обычно как ![]() ).
).
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Mэкв = fэкв×M (1 вариант написания)
2 вариант ,он немного понятнее:
Эквивалент, как частица, может быть охарактеризован молярной массой. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
МЭ = МfЭ. |
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
МЭ(оксида) = МЭ(элемента) + МЭ(О) = МЭ(элемента) + 8 МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) = 1 + МЭ(кислотного остатка) МЭ(основания) = МЭ(Ме) + МЭ(ОН) = МЭ(Ме) + 17 МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка). |
Как решить задачу не знаю
