
- •Введение
- •1. Выбор и обоснование тепловой схемы установки
- •2. Тепловой и конструктивный расчет колонны
- •2.1 Материальный баланс колонны
- •2.2 Массовые концентрации низкокипящго компонента
- •2.3 Флегмовое число
- •2.4 Определение числа тарелок
- •2.5 Определение числа тарелок графическим путем
- •2.6 Конструктивный расчет колонны
- •2.7 Гидравлический расчет колонны
- •2.8 Тепловой баланс колонны
2. Тепловой и конструктивный расчет колонны
2.1 Материальный баланс колонны
Материальный баланс колонны
![]() ,
(2.1)
,
(2.1)
где Gf – расход свежей смеси;
Gw – расход кубовых остатков;
Gd – расход готовой продукции.
Уравнение материального баланса для низкокипящего компонента :
![]() ,
(2.2)
,
(2.2)
где
![]() - молярная концентрация исходной смеси
в жидкой фазе;
- молярная концентрация исходной смеси
в жидкой фазе;
![]() - молярная концентрация дистиллята в
жидкой фазе;
- молярная концентрация дистиллята в
жидкой фазе;
![]() - молярная концентрация кубовых остатков
в жидкой фазе.
- молярная концентрация кубовых остатков
в жидкой фазе.
Составим систему уравнений из (2.1) и (2.2):
![]()
Решив систему уравнений, получим:
![]() ,
,
![]() кг/с.
кг/с.
![]() кг/с.
кг/с.
2.2 Массовые концентрации низкокипящго компонента
Для двухкомпонентной смеси с компонентами А и Б с молекулярными весами компонентов
![]()
![]()
массовые концентрации определяются:
а) в исходной смеси
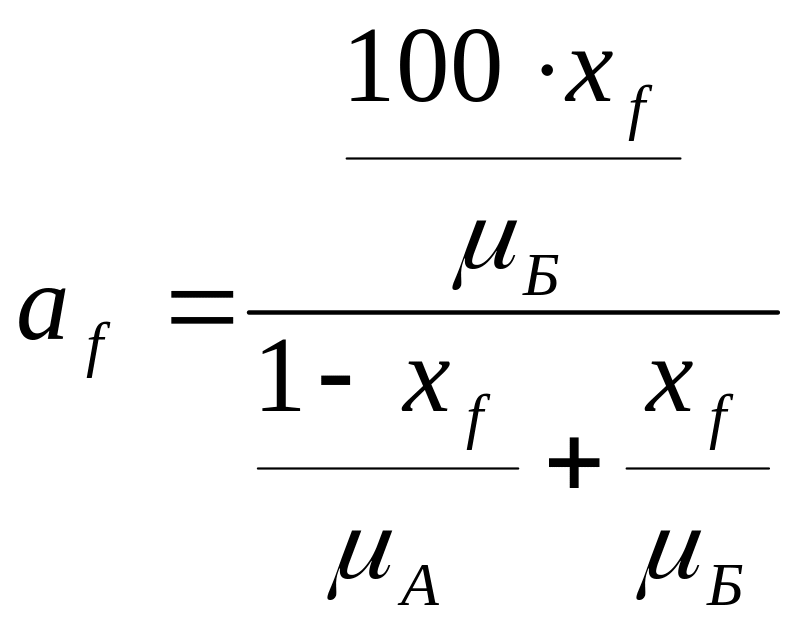 (2.3)
(2.3)
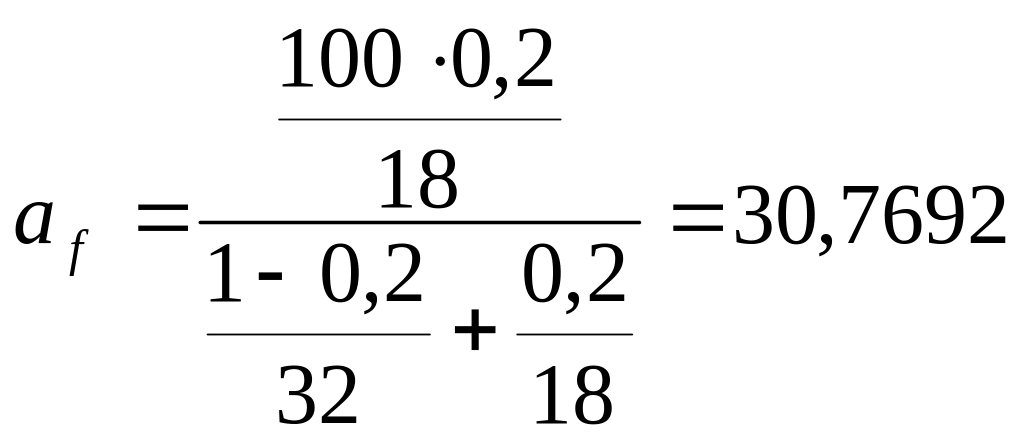
б) в готовом продукте
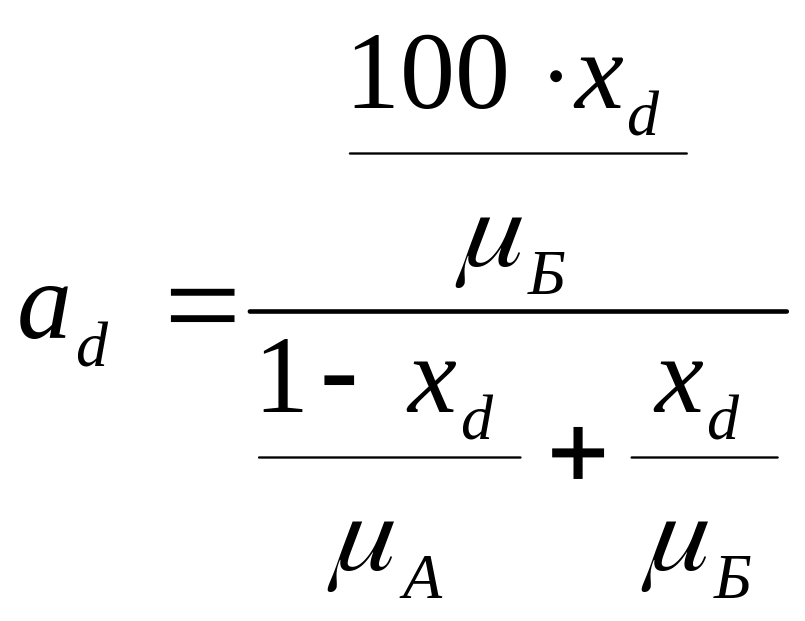 (2.4)
(2.4)

в) в кубовом остатке
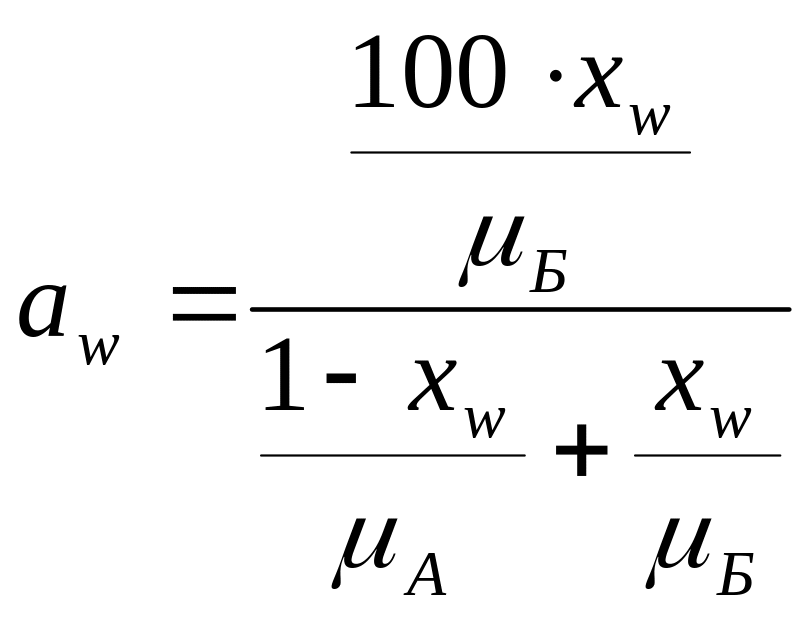 (2.5)
(2.5)
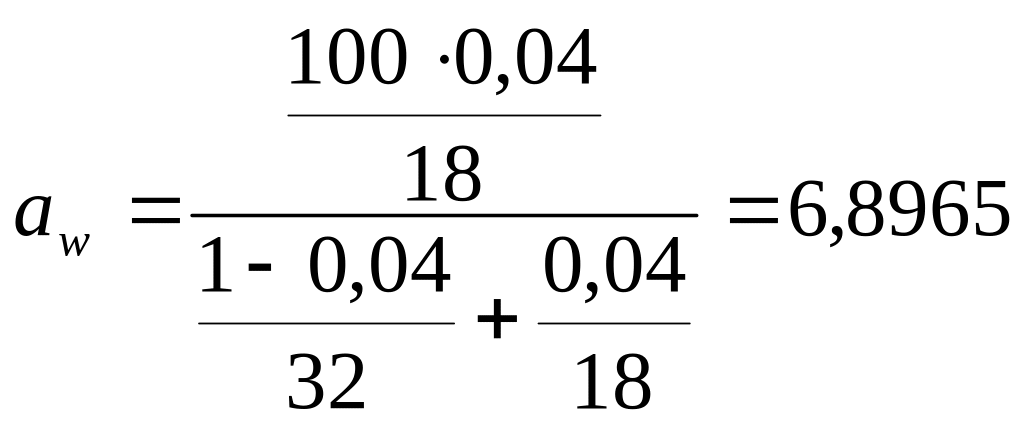

2.3 Флегмовое число
Флегмовое число предварительно может быть определено по формуле:
![]() , (2.6)
, (2.6)
Минимальное флегмовое число:
![]() , (2.7)
, (2.7)
где - молярная концентрация дистиллята в жидкой фазе;
- молярная концентрация исходной смеси в жидкой фазе;
![]() - молярная концентрация исходной смеси
в паровой фазе.
- молярная концентрация исходной смеси
в паровой фазе.
2.4 Определение числа тарелок
Задаваясь значением температур в промежутке от tA до tB, из уравнения Антуана определяют давления насыщения низкокипящего компонента при данных температурах:
![]() ,
,
![]() (2.6)
(2.6)
где t – температура насыщения компонента смеси, оC;
T – температура насыщения компонента смеси, К ;
А, В, С – коэффициенты пропорциональности (для метилового спитра: А=8,349, В=1835; для воды А=8,07414, В=1733, С=233,84 [1]).
Для температур t1=71,1 оC, t2=77,5 оC, t3=83,9 оC, t4=90,3 оC, t5=96,7 оC давления насыщения низкокипящего компонента по формуле (2.6) соответственно составят:
![]() Па
Па
![]() Па
Па
![]() Па
Па
![]() Па
Па
![]() Па
Па
Задаваясь значением температур в промежутке от tA до tB определяют давления насыщения высококипящего компонента при данных температурах. Для температур t1=71,1 оC, t2=77,5 оC, t3=83,9 оC, t4=90,3 оC, t5=96,7 оC давления насыщения высококипящего компонента соответственно составят:
![]() Па
Па
![]() Па
Па
![]() Па
Па
![]() Па
Па
![]() Па
Па
Мольные концентрации низкокипящего компонента в жидкой фазе определяются по формуле:
![]() ,
(2.7)
,
(2.7)
где Pобщ – общее давление смеси, Па. Принимаем равным давлению при нормальных условиях 101325 Па.
![]()
![]()
![]()
![]()
![]()
Используя закон Рауля, определяют концентрации низкокипящего компонента в паровой фазе в интервале температур от tA до tB:
![]() ,
(2.8)
,
(2.8)

![]() ,
(2.9)
,
(2.9)
где PA – парциальное давление низкокипящего компонента при температуре ti, Па.
![]() Па
Па
![]() Па
Па
![]() Па
Па
![]() Па
Па
![]() Па
Па
![]()
![]()
![]()
![]()
![]()
Определяется теоретическое число тарелок, при котором обеспечивается полное физическое равновесие между стекающей с тарелки жидкостью и поднимающимся паром при равномерном распределении пара по сечению тарелки. Равновесные молекулярные доли жидкости (х) и пара (y) и температуры кипения смеси метилоый спирт – вода приведены в таблице 2.1.
Таблица 2.1. – Молекулярные доли жидкости и пара смеси метиловый спирт – вода.
t, 0C |
100 |
96,3 |
91,9 |
87,5 |
83,3 |
79 |
64,7 |
x, % |
0 |
5,27 |
12,56 |
20,85 |
29,88 |
40,47 |
100 |
y, % |
0 |
16,71 |
34,7 |
50 |
62,44 |
73,18 |
100 |
Строим фазовую диаграмму и диаграмму равновесия бинарной смеси метиловый спирт-вода.
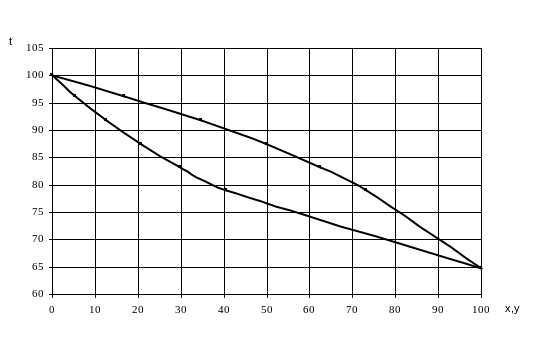
 Рисунок
2.1 – Фазовая диаграмма бинарной смеси
метиловый спирт-вода
Рисунок
2.1 – Фазовая диаграмма бинарной смеси
метиловый спирт-вода
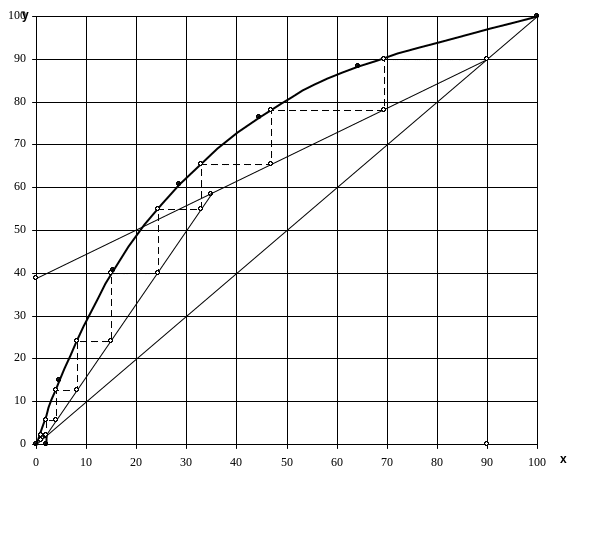
Рисунок 2.2 - Диаграмма равновесия бинарной смеси метиловый спирт-вода
На диаграмме равновесия отмечаются
молярные концентрации компонентов в
жидкой фазе![]() .
Им соответствуют молярные концентрации
компонентов в паровой фазе
.
Им соответствуют молярные концентрации
компонентов в паровой фазе
![]() .
.
По (2.7) определяется минимальное значение флегмового числа:
![]()
Определяется оптимальное флегмовое число по формуле:
![]() (2.10)
(2.10)
![]()
 Уравнение
рабочей линии верхней части колонны:
Уравнение
рабочей линии верхней части колонны:
![]() (2.11)
(2.11)
где
![]() - отрезок, отсекаемый рабочей линией на
оси ординат.
- отрезок, отсекаемый рабочей линией на
оси ординат.
![]()
Уравнение рабочей линии нижней части колонны:
![]() (2.12)
(2.12)
где
![]() - отрезок, отсекаемый рабочей линией на
оси ординат ниже нулевого уровня.
- отрезок, отсекаемый рабочей линией на
оси ординат ниже нулевого уровня.
Отмечается точка 2 (0,В) и через точки 1 и
2 проводится рабочая линия укрепляющей
части колонны. На эту рабочую линию
выносится значение концентрации
низкокипящего компонента
![]() в исходной смеси и отмечается точка 3.
Эта точка характеризует концентрацию
низкокипящего компонента на питательной
тарелке (рисунок 2.2). Следовательно,
точка 3 является исходной точкой
построения рабочей линии исчерпывающей
части колонны.
в исходной смеси и отмечается точка 3.
Эта точка характеризует концентрацию
низкокипящего компонента на питательной
тарелке (рисунок 2.2). Следовательно,
точка 3 является исходной точкой
построения рабочей линии исчерпывающей
части колонны.
Используя
допущение, что при испарении жидкости
в кипятильнике не происходит изменения
ее состава, то есть состав пара,
образующегося в кипятильнике, соответствует
составу кубового остатка (![]() ),
значение концентрации низкокипящего
компонента в жидкой фазе куба колонны
выносится на диагональ и отмечается
точка 4. Через точку 4 и точку 3 проводится
рабочая линия исчерпывающей части
колонны.
),
значение концентрации низкокипящего
компонента в жидкой фазе куба колонны
выносится на диагональ и отмечается
точка 4. Через точку 4 и точку 3 проводится
рабочая линия исчерпывающей части
колонны.
На тарелке происходит процесс конденсации
и парообразования. Количество таких
ступеней до точки 3 определяет число
теоретических тарелок в укрепляющей
части колонны (![]() тарелки). Количество ступеней от точки
3 до точки 4 дают число теоретических
тарелок в исчерпывающей части колонны
(
тарелки). Количество ступеней от точки
3 до точки 4 дают число теоретических
тарелок в исчерпывающей части колонны
(
![]() тарелок).
тарелок).
Количество реальных (дейстительных) тарелок:
![]() (2.12)
(2.12)
Где
![]() - КПД контактного устройства;
=0,3
… 0,8
- КПД контактного устройства;
=0,3
… 0,8
Количество реальных (дейстительных) тарелок в укрепляющей части колонны:
![]() шт.
шт.
Количество реальных (дейстительных) тарелок в исчерпывающей части колонны:
![]() шт.
шт.
Построение диаграммы фазового равновесия h=f(x,y)
В диапазоне температур кипения чистых компонентов определяют энтальпию кипящей жидкости по формуле, кДж/кг:
![]() ,
(2.13)
,
(2.13)
где
![]() и
и
![]() – изобарные теплоемкости низкокипящего
и высококипящего компонентов
соответственно, кДж/кг∙. Для метилового
спирта
– изобарные теплоемкости низкокипящего
и высококипящего компонентов
соответственно, кДж/кг∙. Для метилового
спирта
![]() ,
для воды
,
для воды
![]() .
.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
В диапазоне температур кипения чистых компонентов определяют энтальпию насыщенного пара по формуле, кДж/кг:

![]() (2.11)
(2.11)
где
![]() ,
,
![]() -
скрытая теплота парообразования, кДж/кг.
Для метилового спирта
-
скрытая теплота парообразования, кДж/кг.
Для метилового спирта
![]() и
и
![]() ,
,
для воды
![]() и
и
![]() .
.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
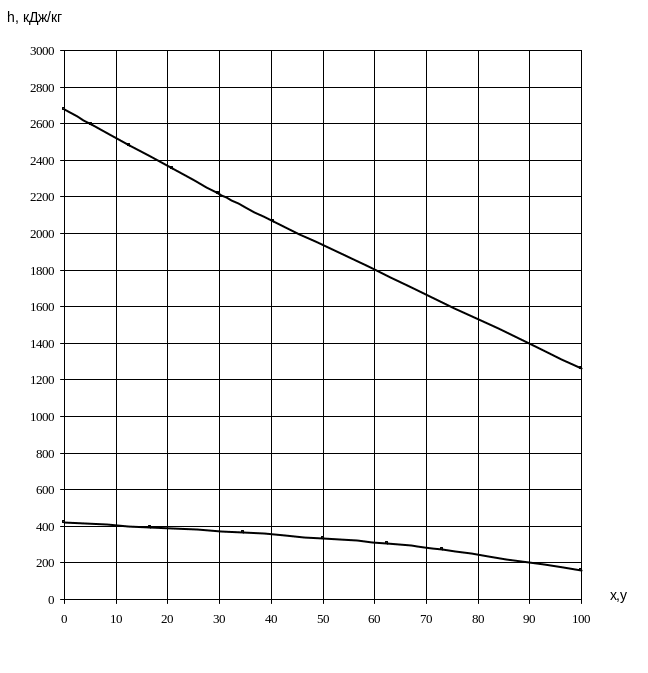
Рисунок 2.3 – Диаграмма фазового равновесия
![]()
