
- •Гистология печени
- •Цитохимия и ультраструктура печеночных клеток
- •Синусоидальные клетки
- •Синусоидальные клетки (Sinusoidal cells)
- •Клетка Ито
- •История
- •Клетки печени
- •Гепатоцитов
- •Клетки ito
- •Клетки Купфера
- •Синусоидальные эндотелиальных клеток
- •Анатомия печени
- •Гистологическое строение печени
- •Функции печени
- •Особенности кровоснабжения печени
- •Механизм обезвреживания токсинов
- •Болезни печени
- •Регенерация печени
- •Трансплантация печени
- •Биоинженерная печень
Синусоидальные клетки
Синусоидальные клетки (эндотелиальные клетки, клетки Купфера, звёздчатые и ямочные клетки) вместе с обращённым в просвет синусоида участком гепатоцитов образуют функциональную и гистологическую единицу [39].
Эндотелиальные клетки выстилают синусоиды и содержат фенестры, образующие ступенчатый барьер между синусоидом и пространством Диссе (рис. 1-16). Клетки Купфера прикреплены к эндотелию.
Звёздчатые клетки печени располагаются в пространстве Диссе между гепатоцитами и эндотелиальными клетками (рис. 1-17). Пространство Диссе содержит тканевую жидкость, оттекающую далее в лимфатические сосуды портальных зон. При нарастании синусоидального давления выработка лимфы в пространстве Диссе увеличивается, что играет роль в образовании асцита при нарушении венозного оттока из печени.
Клетки Купфера. Это очень подвижные макрофаги, связанные с эндотелием, которые окрашиваются пероксидазой и имеют ядерную оболочку. Они фагоцитируют крупные частицы и содержат вакуоли и лизосомы. Эти клетки образуются из моноцитов крови и имеют лишь ограниченную способность к делению. Они фагоцитируют по механизму эндоцитоза (пиноцитоза или фагоцитоза), который может опосредоваться рецепторами (абсорбционный) или происходить без участия рецепторов (жидкофазный) [41]. Клетки Купфера поглощают состарившиеся клетки, инородные частицы, опухолевые клетки, бактерии, дрожжи, вирусы и паразитов. Они захватывают и перерабатывают окисленные липопротеины низкой плотности (которые считаются атерогенными) [14] и удаляют денатурированные белки и фибрин при диссеминированном внутрисосудистом свёртывании крови.
Клетка Купфера содержит специфические мембранные рецепторы для лигандов, включая фрагмент Fc иммуноглобулина и компонент С3b комплемента, которые играют важную роль в представлении антигена.
Клетки Купфера активируются при генерализованных инфекциях или травмах. Они специфически поглощают эндотоксин и в ответ вырабатывают ряд факторов, например фактор некроза опухоли, интерлейкины, коллагеназу и лизосомальные гидролазы. Эти факторы усиливают ощущение дискомфорта и недомогания. Токсическое действие эндотоксина, таким образом, обусловлено продуктами секреции клеток Купфера, поскольку сам по себе он нетоксичен.
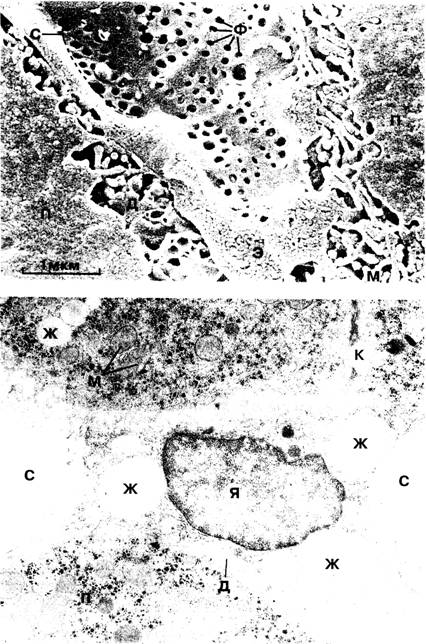
Рис. 1-16. Электронная микрофотография синусоида, на которой видны фенестры (Ф), образующие ситовидные пластинки (С). П — паренхиматозная клетка; Д — пространство Диссе; М — микроворсинки; Э — эндотелиальная клетка.
Рис. 1-17. Электронная микрофотография звёздчатой клетки печени. Видны характерные жировые капли (Ж). С — просвет синусоида; Д — пространство Диссе. П — паренхиматозная клетка. К — жёлчный каналец. Я — ядро. М — митохондрия, х 12 000.
Клетка Купфера секретирует также метаболиты арахидоновой кислоты, в том числе простагландины [39].
Клетка Купфера имеет специфические мембранные рецепторы к инсулину, глюкагону и липопротеинам. Углеводный рецептор N-ацетилгликозамина, маннозы и галактозы может служить посредником в пиноцитозе некоторых гликопротеинов, особенно лизосомальных гидролаз. Кроме того, он опосредует поглощение иммунных комплексов, содержащих IgM.
В печени плода клетки Купфера выполняют эритробластоидную функцию. Распознавание и скорость эндоцитоза клетками Купфера зависят отопсонинов, фибронектина плазмы, иммуноглобулинов и тафтсина — естественного иммуномодуляторного пептида [25|.
Эндотелиальные клетки. Эти оседлые клетки образуют стенку синусоидов. Фенестрированные участки эндотелиальных клеток (фенестры) имеют диаметр 0,1 мкм (см. рис. 1-16) и образуют ситовидные пластинки, которые служат биологическим фильтром между синусоидальной кровью и плазмой, заполняющей пространство Диссе. Эндотелиальные клетки имеют подвижный цитоскелет, который поддерживает и регулирует их размеры [11]. Эти «печёночные сита» фильтруют макромолекулы различного размера. Через них не проходят крупные, насыщенные триглицеридами хиломикроны, а более мелкие, бедные триглицеридами, но насыщенные холестерином и ретинолом остатки могут проникать в пространство Диссе [16]. Эндотелиальные клетки несколько различаются в зависимости от расположения в дольке. При сканирующей электронной микроскопии видно, что количество фенестр может значительно уменьшаться с образованием базальной мембраны [22]; особенно ярко эти изменения проявляются в зоне 3 у больных алкоголизмом.
Синусоидальные эндотелиальные клетки активно удаляют из кровообращения макромолекулы и мелкие частицы с помощью рецепторно-опосредованного эндоцитоза [40]. Они несут поверхностные рецепторы к гиалуроновой кислоте (главный полисахаридный компонент соединительной ткани), хондроитинсульфату и гликопротеину, содержащему на конце маннозу, а также рецепторы типа II и III к фрагментам FcIgG и рецептор к белку, связывающему липополисахариды [37]. Эндотелиальные клетки выполняют очистительную функцию, удаляя ферменты, повреждающие ткани, и патогенные факторы (в том числе микроорганизмы). Кроме того, они очищают кровь от разрушенного коллагена и связывают и поглощают липопротеины.
Звёздчатые клетки печени (жирозапасающие клетки, липоциты, клетки Ито). Эти клетки расположены в субэндотелиальном пространстве Диссе. Они содержат длинные выросты цитоплазмы, некоторые из которых тесно контактируют с паренхиматозными клетками, а другие достигают нескольких синусоидов, где могут участвовать в регуляции кровотока и, таким образом, влиять на портальную гипертензию [6]. В нормальной печени эти клетки являются как бы основным местом хранения ретиноидов; морфологически это проявляется в виде жировых капель в цитоплазме. После выделения этих капель звёздчатые клетки становятся похожими на фибробласты. Они содержат актин и миозин и сокращаются при воздействии эндотелина-1 и вещества Р [36]. При повреждении гепатоцитов звёздчатые клетки утрачивают жировые капли, пролиферируют, мигрируют в зону 3, приобретают фенотип, напоминающий фенотип миофибробластов, и вырабатывают коллаген типа I, III и IV, а также ламинин. Кроме того, они выделяют протеиназы клеточного матрикса и их ингибиторы, например тканевый ингибитор металлопротеиназ (см. главу 19) [4, 23]. Коллагенизация пространства Диссе приводит к снижению поступления в гепатоцит субстратов, связанных с белком [46].
Ямочные клетки. Это очень подвижные лимфоциты — естественные киллеры, прикреплённые к обращённой в просвет синусоида поверхности эндотелия [10]. Их микроворсинки или псевдоподии проникают сквозь эндотелиальную выстилку, соединяясь с микроворсинками паренхиматозных клеток в пространстве Диссе. Эти клетки живут недолго и обновляются за счёт лимфоцитов циркулирующей крови, дифференцирующихся в синусоидах [43]. В них обнаруживаются характерные гранулы и пузырьки с палочками в центре. Ямочные клетки обладают спонтанной цитотоксичностью по отношению к опухолевым и инфицированным вирусом гепатоцитам.
Взаимодействия синусоидальных клеток
Между клетками Купфера и эндотелиальными клетками, как и между клетками синусоидов и гепатоцитами, происходит сложное взаимодействие. Активация клеток Купфера липополисахаридами подавляет поглощение гиалуроновой кислоты эндотелиальными клетками. Этот эффект, возможно, опосредуется лейкотриенами [12]. Образованные клетками синусоидов цитокины могут как стимулировать, так и подавлять пролиферацию гепатоцитов [26].
Внеклеточный матрикс
Внеклеточный матрикс становится видимым только при заболеваниях печени. В пространстве Диссе можно обнаружить все главные компоненты базальной мембраны, в том числе коллаген типа IV, ламинин, гепарансульфат, протогликан и фибронектин [9]. Все клетки, образующие синусоид, могут участвовать и в образовании матрикса. Матрикс, находящийся в пространстве Диссе, влияет на функцию гепатоцитов, изменяя экспрессию тканеспецифических генов, например гена альбумина, а также количество и порозность синусоидальных фенестраций [27]. Это может иметь значение для регенерации печени.
Нарушение микроциркуляции печени при патологии [46]
При заболеваниях печени, например при алкогольном поражении, может нарушаться микроциркуляция печени из-за коллагенизации пространства Диссе, образования базальной мембраны под эндотелием и изменения его фенестрированности [22]. Все эти процессы наиболее выражены в зоне 3. Они приводят к потере питательных веществ, предназначенных для гепатоцитов, и к развитию портальной гипертензии.
Адгезивные молекулы
При воспалении в печени часто обнаруживается инфильтрация лимфоцитами. Рецепторы на поверхности лимфоцитов, антиген, ассоциированный с функцией лейкоцитов (LFA-1), и молекулы межклеточной адгезии (ICAM-1 и ICAM-2) взаимодействуют между собой. В норме ICAM-1 экспрессируется в основном на клетках, выстилающих синусоиды, и в незначительной степени — на портальном и печёночном эндотелии (рис. 1-18) [1]. При реакциях отторжения трансплантата выявлена индукция ICAM-1 в эпителии жёлчных путей, эндотелии сосудов и в перивенулярных гепатоцитах. Экспрессия этих молекул адгезии на клетках жёлчных протоков показана при первичном билиарном циррозе и первичном склерозирующем холангите [2].
Функциональная неоднородность [18]
Функции клеток, расположенных в периферической зоне кровообращения ацинуса, примыкающей к терминальным печёночным венам (зона 3), отличаются от функции клеток, примыкающих к терминальным печёночным артериям и портальным венам (зона 1; см. рис. 1-12 и 1-13; табл. 1-1) [191.
Ферменты цикла Кребса (ферменты синтеза мочевины и глутаминазы) в наиболее высоких концентрациях обнаруживаются в зоне 1, в то время как глутаминсинтетаза — в околовенозной зоне.

Рис. 1-18. Ткань нормальной печени, окрашенная на ICAM-1. Видно диффузное окрашивание клеток, выстилающих синусоиды, слабое окрашивание мембран некоторых гепатоцитов; жёлчные протоки не окрашиваются. См. также цветную иллюстрацию на с. 768.
Очевидно, что эти зоны различаются по снабжению кислородом: клетки зоны 3 получают кислород в последнюю очередь и особенно склонны к аноксическому повреждению.
Ферменты цитохрома Р450, участвующие в метаболизме лекарств, в основном сосредоточены в зоне 3. Это особенно ярко проявляется при индукции ферментов, например, фенобарбиталом. Наиболее высокие концентрации токсичных продуктов метаболизма лекарств обнаруживаются в гепатоцитах зоны 3. Кроме того, в них снижена концентрация глутатиона, поэтому гепатоциты зоны 3 оказываются особенно восприимчивыми к лекарственным повреждениям печени.
Таблица 1-1. Метаболизм гепатоцитов в зависимости от их расположения в зоне 3 (центральной) или в зоне 1 (перипортальной) [19]
|
Зона 1 |
Зона 3 |
углеводы |
Гликонеогенез |
Гликолиз |
Белки |
Синтез альбумина и фибриногена |
Синтез альбумина и фибриногена |
Цитоxром P450 |
+ |
++ |
После воздействия фенобарбиталом |
+ |
++++++++ |
Глутатион |
++ |
— |
Снабжение кислородом |
+ + + |
+ |
Образование жёлчи, зависящее от желчных кислот |
++ |
— |
Образование желчи, не зависящее от жёлчных уислот |
— |
++ |
Синусоиды |
Мелкие Много анастомозов |
Прямые Радиальные |
Гепатоциты зоны 1 получают кровь с более высокой концентрацией жёлчных кислот и поэтому играют особенно важную роль в образовании жёлчи, зависящем от жёлчных кислот. Гепатоциты зоны 3 участвуют в образовании жёлчи, не зависящем от жёлчных кислот. Кроме того, имеются зональные различия в скорости переноса веществ из синусоидов в жёлчные канальцы.
Причины метаболических различий между зонами различны. Одни функции (гликонеогенез, гликолиз, кетогенез) зависят от направления движения крови по синусоидам, другие (осуществляемые цитохромом Р450) — от скорости транскрипции генов, которая неодинакова в перивенулярных и перипортальных гепатоцитах [18]. В печени плода выявлены различия в экспрессии глутамин-синтетазы в разных участках ацинуса.
Перенос через синусоидальную мембрану [5]
Синусоидальная мембрана гепатоцита представляет собой домен, который содержит большое количество рецепторов и обладает высокой метаболической активностью. Он отделён от жёлчного канальца латеральным доменом, который участвует в межклеточном взаимодействии (см. рис. 1-14). Рецепторно-опосредованный эндоцитоз обеспечивает перенос крупных молекул, таких, как гликопротеины, факторы роста и белки-переносчики (трансферрин). Эти лиганды связываются с рецепторами синусоидальной мембраны, которые образуют окаймлённые клатрином ямки, обеспечивающие начало эндоцитоза. Судьба лиганда внутри клетки различна (рис. 1-19). Многие лиганды переносятся в лизосомы, где разрушаются, а рецепторы возвращаются на синусоидальную мембрану для повторного использования. Некоторые лиганды переносятся в составе пузырьков через клетку и выделяются в просвет жёлчных канальцев.
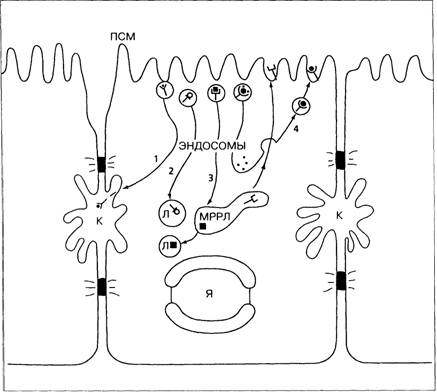
Рис. 1-19. Пути эндоцитоза начиная от синусоидальной мембраны. ПСМ — плазматическая синусоидальная мембрана; К — жёлчный каналец; Л — лизосома; Я — ядро; МРРЛ — место разделения рецептора и лиганда). -Рецепторы, связанные с лигандами, группируются, образуя окаймлённую ямку. Происходит эндоцитоз, приводящий к образованию окаймлённого пузырька, который затем теряет клатриновую оболочку и сливается с другими пузырьками с образованием ранней эндосомы (участок сортировки). В дальнейшем возможны следующие пути: 1 — пузырёк переносится к жёлчному канальцу, где лиганд и рецептор выделяются (трансцитоз, например, полимерного IgA); 2 — перенос лиганда и рецептора в лизосому, где они разрушаются; 3 — рецептор и лиганд переносятся в МРРЛ. Рецептор отделяется от лиганда и возвращается на плазматическую мембрану синусоида. Лиганд входит в лизосому и разрушается (например, липопротеины низкой плотности, асиалогликопротеины, инсулин); 4 — лиганд и рецептор возвращаются на плазматическую мембрану (например, трансферрин и его рецептор после выделения железа).
Эпителиальные клетки жёлчных канальцев
Эпителиальные клетки жёлчных канальцев удалось выделить из печени крысы |3| и получить их короткоживущую культуру. Показано, что эти клетки осуществляют рецепторно-опосредованный эндоцитоз фактора роста эпидермиса и его экзоцитоз, регулируемый секретином |24|.
