
- •Лабораторная работа № 1 Инструктаж по технике безопасности. Основные классы неорганических соединений
- •Лабораторная работа № 2 Химическая кинетика и химическое равновесие
- •Лабораторная работа № 3 Электролитическая диссоциация. Гидролиз растворов
- •Лабораторная работа № 4
- •Плотность растворов сульфата натрия при 20оС
Лабораторная работа № 3 Электролитическая диссоциация. Гидролиз растворов
Цель:
экспериментально изучить электропроводность некоторых веществ и растворов, зависимость реакционной способности от степени диссоциации электролитов, факторы, нарушающие равновесие в растворах электролитов.
Теоретические вопросы:
Электролиты. Сильные и слабые электролиты.
Электролитическая диссоциация. Основные положения теории Аррениуса.
Степень и константа диссоциации. Факторы, влияющие на степень диссоциации.
Равновесие в растворах электролитов.
Влияние одноименных ионов на диссоциацию слабых электролитов.
Электролиты – вещества, способные распадаться на ионы (положительные катионы и отрицательные анионы), их растворы проводят электрический ток.
Неэлектролиты – не распадаются на ионы, их растворы не проводят ток.
Электролитическая диссоциация – распад молекул электролита на ионы в растворе или расплаве.
Диссоциация классов соединений:
кислот HNO3 H+ + NO3–
многоосновных кислот ступенчато, в основном по первой ступени:
H2S H+ + HS– (первая ступень)
HS– H+ + S2– (вторая ступень)
оснований NaOH Na+ + OH–
многокислотных оснований ступенчато, в основном по первой ступени
Mg(OH)2 MgOH+ + OH– (первая ступень)
MgOH+ Mg2+ + OH– (вторая ступень)
амфотерных оснований возможна как кислот и как оснований:
2H+ + SnO22– H2SnО2 Sn(OH)2 Sn2+ + 2OH–
всех солей растворимых в воде – практически полностью, из них:
средних солей Al2(SO4)3 2Al3+ + 2SO42–
кислых солей ступенчато, в основном по 1 ступени
NaHCO3 Na+ + HCO3– (первая ступень)
HCO3– H+ + CO32– (вторая ступень)
основных солей ступенчато, в основном по 1 ступени
CuOHCl CuOH+ + Cl– (первая ступень)
CuOH+ Cu+2 + OH– (вторая ступень)
двойных солей KAl(SO4)2 K+ + Al3+ + 2SO42–.
комплексных солей Na2[Zn(OH)4] 2Na+ + [Zn(OH)4)]2–
О силе электролита можно судить по электропроводности его раствора и по химической активности в реакциях ионного обмена.
Степень диссоциации (α) – отношение числа молекул электролита распавшихся на ионы к общему числу его молекул в растворе. Понятие степени диссоциации неприменимо к сильным электролитам.
Сильные электролиты – вещества, диссоциирующие в растворах полностью:
сильные кислоты |
HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4 |
щелочи |
NaOH, KOH, LiOH, RbOH, Ba(OH)2, Ca(OH)2 |
соли |
Все растворимые в воде |
Слабые электролиты – вещества, диссоциирующие частично, в их растворах устанавливается равновесие между молекулами и ионами.
<3% Н2О, СН3СООН, H2C2O4;
=3÷30% – HNO2, HCN, H2S, H2CO3, NH4OH, гидроксиды металлов, кроме щелочей.
Константа диссоциации (Кдис) – константа равновесия процесса диссоциации, количественная характеристика слабых электролитов, не зависит от концентрации раствора.
N H4OH NH4++
OH–
H4OH NH4++
OH– 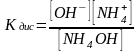
Закон разбавления Оствальда связывает константу и степень диссоциации:
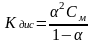 ,
где
,
где
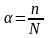 , См
- молярная концентрация
, См
- молярная концентрация
Если α значительно меньше 1, уравнение закона Оствальда упрощается:
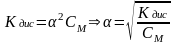 ,
т.е. при разбавлении степень диссоциации
вырастает.
,
т.е. при разбавлении степень диссоциации
вырастает.
Для
бинарного электролита КАn
(например НСlO,
HCSN):
[К+]=[Аn–]=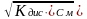 .
.
Показатель константы диссоциации: PК = – lg Кдис.
Изменение условий смещает динамическое равновесие процесса диссоциации:
Разбавление приводит к возрастанию степени диссоциации электролитов.
Добавка одноименного иона, т.е. увеличение концентрации одного из ионов ведет к снижению степени диссоциации электролита.
Гидролиз солей – взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора.
Гидролизу подвергается ион слабого электролита, возможны 3 типа гидролиза.
1.Гидролиз по аниону Соль сильного основания и слабой кислоты СН3СООNa.
Молекулярное уравнение: CH3COONa + H2O CH3COOH + NaOH
Ионно-молекулярное уравнение: СН3СОО– + НОН СН3СООН + ОН–
Образующиеся при диссоциации анионы СН3СОО– связываются в слабый электролит СН3СООН. Ионы ОН– накапливаются, создавая в растворе щелочную среду (рН>7). Гидролиз тем сильнее, чем меньше Кдисс образующейся слабой кислоты.
Гидролиз солей многоосновных кислот протекает по стадиям, преимущественно по первой стадии.
1 стадия: K2S + H2O KHS + KOH
S2– + HOH HS– + OH–
2 стадия: KHS + H2O H2S + KOH
HS-– + HOH H2S + OH–
Гидролиз по катиону. Соль слабого основания и сильной кислоты CuSO4 Гидролиз идет по катиону Cu2+ и протекает в две стадии с образованием преимущественно основной соли.
Реакция среды кислая (рН<7), в растворе накапливаются ионы водорода Н+. Гидролиз тем сильнее, чем меньше Кдисс образующегося основания.
1 стадия: Cu2+ + H2O CuOH+ + H+
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4
2 стадия: CuOH+ + HOH Cu(OH)2 + H+
(CuOH)2SO4 + 2H2O 2Cu(OH)2 + H2SO4
3. Гидролиз по катиону и аниону. Соль слабого основания и слабой кислоты CH3COONH4.
NH4+ + CH3COO– + HOH NH4OH + CH3COOH
Среда раствора нейтральная, слабокислая или слабощелочная в зависимости от Кдисс образующихся слабых электролитов.
Усиление гидролиза, совместный гиролиз солей слабого основания CrCl3 и слабой кислоты Na2S приводит к необратимому гидролизу каждой из солей до конца с образованием слабого основания и слабой кислоты.
Гидролиз соли CrCl3 идет по катиону: Cr3+ + HOH CrOH2+ + H+
Гидролиз соли Na2S идет по аниону: S2– + HOH HS– + OH–
Гидролиз усиливается, т.к. образуется слабый электролит Н2О: H++OH–=Н2О
Молекулярное уравнение: 2CrCl3+3Na2S+6H2O=2Cr(OH)3+3H2S+6NaCl Ионно-молекулярное уравнение: 2Cr3+ + 3S2– + 6H2O = 2Cr(OH)3 + 3H2S
Соли сильных оснований и сильных кислот гидролизу не подвергаются, т.к. ни один из ионов соли не образует с ионами Н+ и ОН– воды слабых электролитов. Водные растворы таких солей имеют нейтральную среду.
Практическое задание:
Степень диссоциации СНзСООН в 0,1М растворе равна 1,32∙10-5 Кдис и рК кислоты.
Кдис HCN равна 7.9∙10-10. Найти степень диссоциации HCN в 0,001 М растворе.
Вычислить концентрацию ионов водорода в 0,1 М растворе НСlO ( Кдис=5·10-8)
Во сколько раз уменьшится [H+] в 0,2 М растворе НСООН (Кдис=0,8·10-4), если к 1л этого раствора добавить 0,1моль соли НСООNа (соль диссоциирует полностью)?
Написать ионное уравнение реакции: Мg(ОН)2 + 2НС1 = МgС12 + Н2О
Написать уравнения ступенчатой диссоциации фосфорной кислоты в водном растворе. Вычислите Кдис Н3РО4 по 1-й ступени, если в 0,1 н растворе α=36 %.
Какое значение рН имеет раствор уксусной кислоты с массовой долей ω=0,6%?
Будет ли одинаковой электрическая проводимость водных и спиртовых растворов одного и того же вещества при одной и той же концентрации?
Объясните.
Опыт 1.Сравнение электропроводности растворов некоторых веществ
Угольные электроды, укрепленные на деревянной дощечке и последовательно соединенные с лампой, включить в электрическую сеть
Соблюдая меры предосторожности поочередно опускать электроды в стаканы с веществами и растворами, указанными в таблице, каждый раз промывая электроды в стакане с дистиллированной водой.
Наблюдать загорание электрической лампы
Внести данные в Таблицу 1, записать уравнения реакции
Объяснить разницу в степени накала лампочки в растворах.
Вделать вывод о силе электролитов по силе накала лампы.
Опыт 2. Сравнение химической активности кислот. Взаимодействие соляной и уксусной кислот с мрамором.
В одну пробирку внести 3-4 капли 2н раствора уксусной кислоты СН3СООН ,
В другую 3-4 капли 2н раствора соляной кислоты НСl .
Выбрать два одинаковых по величине кусочка мрамора СаСО3
Бросить по одному кусочку в каждую пробирку.
Наблюдать выделение газа и отметить в какой из из пробирок более активно.
Написать молекулярные и ионные уравнения реакции.
Вделать вывод, какой газ выделяется.
Оценить силу кислот по скорости протекания реакции.
Сделать вывод от концентрации каких ионов зависит скорость выделения газа и в растворе какой из кислот их больше?
Опыт 3. Сравнение химической активности кислот. Взаимодействие соляной и уксусной кислот с цинком
В одну пробирку внести 3-4 капли 2н раствора уксусной кислоты СН3СООН ,
В другую 3-4 капли 2н раствора соляной кислоты НСl .
Бросить по одному кусочку цинка Zn в каждую пробирку.
Наблюдать выделение газа и отметить в какой из пробирок более активно.
Написать молекулярные и ионные уравнения реакции.
Вделать вывод, какой газ выделяется.
16.Оценить силу кислот по скорости протекания реакции.
17. Сделать вывод от концентрации каких ионов зависит скорость выделения газа и в растворе какой из кислот их больше?
Опыт 4. Равновесие в растворах слабых электролитов. Влияние соли слабой кислоты на диссоциацию этой кислоты
В 2 пробирки налить по 5-7 капель 0,1н раствора уксусной кислоты и по 1 капле индикатора метилового оранжевого.
В одну из пробирок внести 3-4 микрошпателя ацетата натрия и перемешать.
Отметить изменение интенсивности окраски во 2-й пробирке.
Объяснить как изменяются степень диссоциации уксусной кислоты и концентрация ионов Н+? Объяснить, как смещается равновесие диссоциации кислоты при добавлении к ней ацетата натрия.
Написать уравнение диссоциации уксусной кислоты и выражение концентрации диссоциации.
Таблица 1
№ п/п |
Вещество или раствор |
Формула |
Электро- проводность |
Виды частиц в стакане |
Уравнение диссоциации (если диссоциирует) |
||
молекулы |
катионы |
анионы |
|||||
1 |
Соль сухая измельченная |
NaCl |
|
|
|
|
|
2 |
Сахар сухой измельченный |
С12Н11О5 |
|
|
|
|
|
3 |
Раствор соли |
NaCl |
|
|
|
|
|
4 |
Вода дистилированная |
Н2О |
|
|
|
|
|
5 |
Раствор сахара |
С12Н11О5 |
|
|
|
|
|
6 |
Соляная кислота (0,1Н) |
НСl |
|
|
|
|
|
7 |
Раствор едкого натра (0,1Н) |
NаОН |
|
|
|
|
|
8 |
Раствор уксусной кислоты (0,1Н) |
СН3СООН |
|
|
|
|
|
9 |
Раствор аммиака (0,1Н) |
NH4OН |
|
|
|
|
|
10 |
Растворы уксусной кислоты и аммиака |
СН3СООН и NH4OН |
|
|
|
|
|
Опыт 5. Влияние соли слабого основания на диссоциацию этого основания
В 2 пробирки налить 5-7 капель 0,1 н раствора аммиака и 1 каплю индикатора фенолфталеина.
В одну из пробирок внести 3-4 микрошпателя хлорида аммония и перемешать.
Сравнить окраску полученного раствора с окраской контрольного раствора.
Объяснить изменение окраски раствора при введении хлорида аммония.
Написать уравнение диссоциации и Кдис гидроксида аммония.
Дать общий вывод о смещении равновесия в растворах слабых электролитов.
Опыт 6. Определение реакции среды растворов солей при гидролизе
В пробирки в водой внести по одному микрошпателю кристаллов солей, указанных в таблице:
Определить РН раствора в каждой пробирке индикаторной бумагой.
Сравнить окраску индикатора в растворах солей и в воде.
Зполнить Таблицу 2.
Таблица 2
№ пробирки |
Название соли |
Формула соли |
Соль образована |
Окраска индикаторной бумаги |
РН раст-вора |
Реакция среды |
Уравнение гидролиза |
|
Сила кислоты |
Сила основания |
|||||||
1 |
ацетат натрия |
|
|
|
|
|
|
|
2 |
хлорид алюминия |
|
|
|
|
|
|
|
3 |
карбонат натрия |
|
|
|
|
|
|
|
4 |
карбонат аммония |
|
|
|
|
|
|
|
5 |
хлорид калия |
|
|
|
|
|
|
|
6 |
ацетат аммония |
|
|
|
|
|
|
|
7 |
дистиллированная вода |
|
|
|
|
|
|
|
