Скорость химической реакции.
Раздел химии, который изучает скорость химической реакции и ее зависимость от различных факторов называют химической кинетикой.
Скорость химической реакции - это изменение концентрации (моль/л) одного из реагирующих веществ или одного из продуктов реакции в единицу времени (сек., мин., ч.) при неизменном объеме системы.
Реакции, которые протекают в растворах и между веществами в газообразном состоянии (между веществами, которые находятся в одной фазе) – гомогенные реакции. Например, реакция между азотом и водородом при синтезе аммиака.
N2(газ) + 3H2 (газ) = 2NH3 (газ)
Реакции, в которых реагирующие вещества не образуют гомогенную среду – гетерогенные . Например, реакция горения угля. С(тв.) + О2 (газ) = CO2 (газ)
Участвующие вещества связаны уравнением реакции, и по изменению концентрации одного из веществ можно судить об изменениях концентрации всех остальных.
Условно гомогенную реакцию выразим уравнением:
А + В = С + D
Допустим, концентрация вещества А в некоторый момент времени (t1) составляет С1 моль/л. В момент времени (t2) концентрация вещества А станет меньше - С2 моль/л (концентрация исходных веществ во времени уменьшается, т.к. вещества вступают в реакцию, т.е. расходуются). Тогда скорость реакции:
![]()
Знак минус указывает на уменьшение концентрации реагентов. Для продуктов реакции ΔC положительная величина, т.к. концентрация продуктов в ходе реакции возрастает, а скорость реакции – величина положительная, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
![]()
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая .
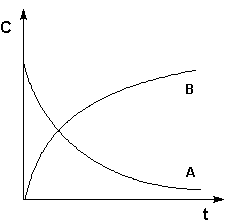
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Факторы, влияющие на скорость реакции.
I. Концентрации реагирующих веществ. Определяется основным законом химической кинетики - законом действующих масс:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях соответствующих коэффициентов.
Закон действующих масс не учитывает реагирующие вещества, находящиеся в твердом состоянии, т.к. их концентрация постоянна и они реагируют лишь на поверхности
Для реакции А + В = С + D и С + D = А + В
соответственно
![]()
Это уравнение называется кинетическим уравнением реакции, где c- концентрация веществ(моль/л).
k- константа скорости реакции, численно равная скорости химической реакции при концентрации реагирующих веществ в 1 моль/л.
Кинетическое уравнение реакции можно записать, используя другие обозначения молярных концентраций реагентов:
V прямой реакции =k1∙[A]a∙[B]b ; V обратной реакции =k2∙[С]с∙[D]d
Константа скорости (k) зависит от:
– природы реагирующих веществ
– температуры
– наличия катализатора
Не зависит от концентраций веществ.
Пример №1.
2 NO(газ) + O2(газ) = 2 NO2
v = k[NO]2[O2]
Пример №2.
С(тв)+О2(газ)→СО2
v = k[O2]
Температура.
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа (1884г.)
При повышении температуры на каждые 100С скорость реакции увеличивается в 2-4 раза.
Впервые в истории науки Вант-Гоффу была вручена за это Нобелевская премия по химии.
Математически правило Вант-Гоффа записывается следующей формулой:
![]() =
γ
=
γ![]() ,
где γ – температурный коэффициент
скорости реакции, который показывает,
во сколько раз увеличивается скорость
реакции при повышении температуры на
10 градусов,
– показатель степени, в которую
возводится γ (гамма)
,
где γ – температурный коэффициент
скорости реакции, который показывает,
во сколько раз увеличивается скорость
реакции при повышении температуры на
10 градусов,
– показатель степени, в которую
возводится γ (гамма)
Примеры решения задач.
Задача 1. Реакция при температуре 50° С протекает за 2 мин 15 с. За сколько времени закончится эта реакция при температуре 70° С, если в данном температурном интервале температурный коэффициент скорости реакции равен 3?
Решение. При увеличении температуры с 50 до 70o С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
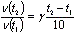
где t2 = 70° С, t1 = 50° С, а v (t2) и v(t1) - скорости реакции при данных температурах. Получаем
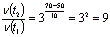
т.е. скорость реакции увеличивается в 9 раз.
В соответствии с определением скорость реакции обратно пропорциональна времени реакции, следовательно, время, за которое закончится реакция при 700С, будет в 9 раз меньше.
Учитывая, что τ (t1) = 135 с (2 мин 15 с), определяем время реакции при температуре t2: 135 сек/9=15 сек.
Только для МГУ:
Задача 4. При стандартных условиях теплота полного сгорания белого фосфора равна 760,1 кДж/моль, а теплота полного сгорания черного фосфора равна 722,1 кДж/моль. Чему равна теплота превращения черного фосфора в белый при стандартных условиях?
Решение. Реакция сгорания 1 моля черного фосфора имеет вид:
Р(ч) + 5/4О2 = 1/2Р2О5 + 722,1 кДж/моль.
Этот же процесс можно провести в две стадии: сначала превратить 1 моль черного фосфора в 1 моль белого:
P(ч) = Р(б) + Q
а затем - сжечь белый фосфор:
Р(б) + 5/4О2 = 1/2Р2О5 + 760,1 кДж/моль.
По закону Гесса,
722,1 = Q + 760,1,
откуда Q = -38 кДж/моль.
Ответ. -38 кДж/моль.
Задача 5 . Растворение образца цинка в соляной кислоте при 20° С заканчивается через 27 минут, а при 40° С такой же образец металла растворяется за 3 минуты. За какое время данный образец цинка растворится при 55° С?
Решение. Растворение цинка в соляной кислоте описывается уравнением:
Zn + 2HCl = ZnCl2 + H2↑.
Поскольку во всех трех случаях растворяется одинаковое количество образца, то можно считать, что средняя скорость реакции обратно пропорциональна времени реакции. Следовательно, при нагревании от 20° С до 40° С скорость реакции увеличивается в
27/3 = 9 раз. Это означает, что коэффициент γ в уравнении Вант-Гоффа
= γ который показывает, во сколько раз увеличивается скорость реакции V при увеличении температуры Т на 10°, равен γ = 3. Значит, при нагревании до 55° С скорость реакции увеличится в 3(55 - 40)10 = 5,2 раза, а время реакции составит 3/5,2 = 0,577 мин, или 34,6 с.
Ответ. 34,6 с.
Катализатор.
В ускорении химической реакции исключительную роль играют катализаторы. Например, в производстве серной кислоты, аммиака, азотной кислоты.
Вещества, которые ускоряют скорость химической реакции, активно участвуют в них, но сами в итоге не расходуются, называются катализаторами.
Реакции протекающие под действием катализатора – каталитические.
Ускорение химических реакций благодаря присутствию катализатора – катализ.
Вещества, которые замедляют скорость химических реакций называют ингибиторами.
Процесс замедления химической реакции – ингибирование (отрицательный катализ).
Примеры каталитических реакций (все примеры выучить наизусть)
4KClO33KClO4+KCl (to, без катализ.)
2KClO3![]() 2KCl+3O2
2KCl+3O2
2Н2О2 2Н2О+О2
2SO2+O2![]() 2SO3
2SO3
4N–3H3 + 3O2 →2N20 + 6Н2O (горение)
4N–3H3
+ 5O2
![]() 4N+2O
+ 6Н2O
4N+2O
+ 6Н2O
N2
+ 3H2
![]() 2NH3
2NH3
4. Природа реагирующих веществ.
– На скорость химической реакции оказывает влияние природа металла: помним, что активность металлов главных подгрупп сравниваем по их положению в ПСХЭ, а металлов побочных – по положению в электрохимическом ряду напряжений.
– Природа электролита. Например, взаимодействие магния протекает быстрее с раствором соляной кислоты, чем с раствором уксусной (той же концентрации).
Mg + 2H+=Mg2+ + H2↑
Кинетическое уравнение реакции выглядит следующим образом:
V=k∙[H+]2. Т.к. скорость данной реакции зависит только от концентрации ионов водорода, а их количество, в свою очередь, от степени электролитической диссоциации, то реакция с участием сильных электролитов протекает быстрее.
Химическое равновесие. Константа равновесия. Примеры. Константа диссоциации. Обратимые и необратимые реакции. Признаки необратимости. Принцип Ле-Шателье. Смещение химического равновесия.
Все химические реакции можно разделить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца (до полного расхода одного из реагентов), а в обратимых ни одно из реагирующих веществ не расходуется полностью, потому что обратимая реакция может протекать как в прямом, так и в обратном направлении.
Признак необратимости: необратимые реакции протекают с образованием осадка, газа или воды. Реакции, протекающие с выделением большого количества теплоты (горения, взрывные) также являются необратимыми.
Пример необратимой реакции:
Zn
+ 4HNO3
![]() Zn(NO3)2
+ 2NO2
+ 2H2O
Zn(NO3)2
+ 2NO2
+ 2H2O
Пример обратимой реакции:
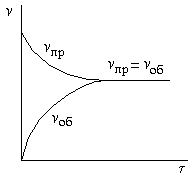
H2 + I2 ↔ 2HI
|
Рисунок – Зависимость скоростей прямой и обратной реакций от времени τ. При равенстве этих скоростей наступает химическое равновесие. |
По мере протекания реакции исходные вещества расходуются, и их концентрации падают. Одновременно появляются продукты реакции, их концентрации возрастают. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие. Оно является динамическим, т.к., хотя концентрации веществ в системе остаются постоянными, реакция продолжает протекать как в прямом, так и в обратном направлении.
Система находится в состоянии равновесия до тех пор, пока внешние условия сохраняются постоянными. При увеличении концентрации какого-либо из веществ, участвующих в реакции, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Когда в реакции участвуют газы, равновесие может нарушаться при изменении давления:
2NO + O2 ↔ 2NO2
vпр=kпр∙[NO]2∙[O2]; vоб=kобр∙ [NO2]2
При увеличении давления, например, в 2 раза концентрация каждого газа возрастет в 2 раза, и новые скорости реакций станут равными vпр1 и vоб1 :
vпр1=8vпр; vоб1=4vоб
Неодинаковое изменение скоростей прямой и обратной реакций связано с тем, что в левой и правой частях уравнения реакции различно число молекул газов. В связи с этим равновесие при возрастании давления сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления.
Принцип Ле-Шателье.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления (в случае газовых реакций) определяется общим положением, известным под названием принципа Ле Шателье:
При изменении внешних условий химическое равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет это внешнее воздействие.
Поясним это на примере реакции синтеза аммиака:
N2 + 3H2 ↔ 2 NH3 + Q
Дадим характеристику этого процесса.
Прямая реакция – реакция соединения. Из двух простых веществ, азота и водорода, образуется одно сложное – аммиак. Обратная реакция – реакция разложения.
Все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывают, а только способствуют более быстрому его достижению.
Прямая реакция протекает с образованием теплоты, поэтому относится к экзотермическим реакциям. Следовательно, обратная реакция – эндотермическая (с поглощением теплоты).
Если внешнее воздействие выражается в увеличении концентрации азота или водорода, то оно благоприятствует реакции, вызывающей уменьшение концентрации этих веществ, и, следовательно, равновесие сместится в сторону образования аммиака. Соответственно увеличение концентрации аммиака смещает равновесие в сторону исходных веществ.
Поскольку прямая реакция, как видно из уравнения, протекает с выделением теплоты, повышение температуры смеси благоприятствует протеканию реакции с поглощением теплоты, и равновесие сместится в сторону исходных веществ; понижение температуры вызовет смещение равновесия в сторону продукта реакции.
Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молекул в левой и правой частях уравнения. В приведенном примере в левой части уравнения содержится четыре молекулы, а в правой - две. Поскольку увеличение давления должно благоприятствовать процессу, ведущему к уменьшению числа молекул, то в данном случае равновесие сместится в сторону продукта реакции. Очевидно, уменьшение давления сместит равновесие в сторону исходных веществ.
Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, например N2 + О2 ↔ 2NO, то изменение давления не вызывает смещения химического равновесия.
Термохимические уравнения. Критерии определения знака теплового эффекта.
Раздел химии, изучающий тепловые эффекты химических реакций называется термохимией. Все химические процессы сопровождаются выделением или поглощением теплоты. Реакции, сопровождающиеся выделением теплоты из системы в окружающую среду, называются экзотермическими, сопровождающиеся поглощением теплоты из окружающей среды, называются эндотермическими. Количество теплоты, которое выделяется или поглощается в ходе реакции, называется тепловым эффектом реакции и обозначается Q. Q измеряется в джоулях или килоджоулях.
Для описания тепловых явлений в химических реакциях принято пользоваться так называемыми термохимическими уравнениями. Термохимические уравнения записываются как обычные уравнения химических реакций, но с указанием величины и знака теплового эффекта реакции. В случае экзотермических реакций с правой стороны уравнения отмечают количество выделившейся теплоты со знаком "плюс", а в случае эндотермических реакций — количество поглощенной теплоты со знаком "минус".
Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом:
Только для МГУ.
Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Это означает, что общий тепловой эффект ряда последовательных реакций будет таким же, как и у любого другого ряда реакций, если в начале и в конце этих рядов одни и те же исходные и конечные вещества.
Рассмотрим пример, поясняющий закон Гесса. Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Один путь включает только одну стадию, а во второй - две стадии, с промежуточным получением кислой соли NaHSO4:
Первый путь (одностадийный): 2 NaOH + H2SO4 = Na2SO4 + 2 H2O + 131 кДж;
Второй путь (двухстадийный):
а) NaOH + H2SO4 = NaНSO4 + H2O + 62 кДж
б) NaHSO4 + NaOH = Na2SO4 + H2O + 69 кДж
Согласно закону Гесса, тепловой эффект получения сульфата натрия из NaOH не зависит от способа получения. Действительно, складывая тепловые эффекты двух последовательных реакций в способе (2) мы получаем тот же тепловой эффект, что и для способа (1): 65 кДж + 69 кДж = 131 кДж. Кстати, почленное сложение двух последних уравнений дает первое уравнение реакции.
Для неорганической химии. Можно не разбирать. Производство аммиака, метанола, серной кислоты, азотной кислоты.