
- •Тематический план лабораторных и практических занятий по химии для студентов лечебного и педиатрического факультетов
- •Правила техники безопасности при работе в химической лаборатории
- •Меры первой помощи
- •Форма отчета
- •Занятие №1
- •Лабораторная работа №1
- •Занятие №4
- •Лабораторная работа №2
- •1. Приведите примеры буферных систем с рН больше или меньше 7 при равных концентрациях кислоты и сопряженного основания.
- •3. Какой из двух буферных растворов характеризуется меньшим значением рН:
- •Занятие №5
- •Лабораторная работа №3
- •Занятие № 6
- •Лабораторная работа №4
- •2. Объясните, почему литий образует малорастворимые в воде соли - фториды, фосфаты, карбонаты, в то время как соли других s-элементов металлов I-а группы хорошо растворимы?
- •3. Какие связи (ионные, ковалентные) характерны в соединениях s-элементов с неметаллами?
- •Занятие №7
- •Лабораторная работа № 5
- •Занятие № 8
- •Лабораторная работа №6
- •Занятие № 9
- •Лабораторная работа №7
- •Занятие №10
- •Лабораторная работа № 8
- •Занятие №11
- •Лабораторная работа № 9
- •1. Напишите уравнение реакции катехина (1,2-дигидроксибензола) с ацетатом свинца
- •2. Напишите уравнение реакции окисления этанола бихроматом калия в кислой среде.
- •Занятие №14
- •Лабораторная работа № 10
- •1. Какое практическое значение имеет реакция -аминокислот с нингидрином?
- •5. Приведите химизм взаимодействия -аланина с хлороводородной кислотой и гидроксидом натрия.
- •7. Какие -аминокислоты в составе белка могут быть обнаружены с помощью ксантопротеиновой реакции?
- •Занятие №15
- •Лабораторная работа № 11
- •Занятие № 16
- •Лабораторная работа № 12
2. Объясните, почему литий образует малорастворимые в воде соли - фториды, фосфаты, карбонаты, в то время как соли других s-элементов металлов I-а группы хорошо растворимы?
____________________________________________________________________________________________________________________________________________________________________________________________________________
3. Какие связи (ионные, ковалентные) характерны в соединениях s-элементов с неметаллами?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Как можно определить каталазную активность тканей?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Какова реакция среды водного раствора NaHCO3? С какой целью применяется водный раствор NaHCO3 в медицине?
___________________________________________________________________________________________________________________________________________________________________________________________________________
Занятие №7
Химия биогенных элементов d-блока. Лигандообменные процессы. Строение металлоферментов, биокомплексные соединений
Лабораторная работа № 5
Биогенные элементы. Свойства d-элементов.
Опыт №1. Получение гидроксо- и аммино-комплексов цинка
Цинк входит в состав более 40 металлоферментов, при этом он образует бионеорганические комплексы с белками и аминокислотами, может находиться в виде комплексов с водой или аммиаком (аква-комплексов и аммиакатов). Получим аммиакатный комплекс цинка.
Методика эксперимента. В пробирку налейте 1-2 мл раствора соли цинка, осторожно по каплям добавьте раствор NaOH или NH4OH до образования осадка. Раствор с полученным осадком разделите на две части, к одной прилейте избыток NaOH, к другой избыток NH4OH. Запишите уравнения реакции получения Zn(OН)2 и уравнения образования гидрокси – и аммино- комплексов цинка.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Запишите наблюдения:
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Cделайте выводы: Какие координационные числа у иона Zn2+ в полученных комплексах и биокомплексах? Какую геометрическую форму имеет Zn2+ в биокомплексах и ферментах?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт № 2. Получение комплексных соединений меди.
Медь является необходимым микроэлементом растительных и животных организмов. В настоящее время известно около 50 медьсодержащих ферментов. Ион меди в этих соединениях образует комплексные соединения – биокластеры с органическими веществами содержащими -NH2, -OH, -SH группы. Модельными комплексными соединениями являются комплексы иона меди с аммиаком, амминокислотой глицином, многоатомными спиртами (этиленгликоль, глицерин), углеводами (глюкоза).
Методика эксперимента. В пробирку налейте 3-4 мл раствора CuSO4 осторожно по каплям добавьте раствор КОН или NaOH до образования осадка. Раствор с полученным осадком разлейте на две части. К одной добавьте избыток раствора NH4OH, к другой раствор глюкозы. Запишите уравнения реакции образование осадка Cu(ОН)2 и растворении его при образовании комплексных соединений.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опишите наблюдаемые явления:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Сделайте выводы: (Какое координационное число проявляет Сu2+, какова геометрическая форма молекулы комплекса? Назовите полученные комплексы)
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт № 3. Получение комплексных соединений железа.
В организме человека содержится 5г железа в виде внутрикомплексных соединений преимущественно в форме Fe+2. Железо депонируется и переносится по организму в в виде комплексов с белком, которые называются ферритин и трансферрин. Примером комплексных соединений железа являются K4[Fe(CN)6] и K3[Fe(CN)6], которые применяются в биохимических анализах и исследованиях. Ниже приведенные реакции являются качественными на ионы Fe+2 и Fe+3 в растворах.
Методика эксперимента.
а) в пробирку поместите 2-3 капли раствора FeSO4, добавьте каплю раствора гексацианоферата (III) калия - K3[Fe(CN)6]. Напишите уравнение реакции, дайте химическое название полученному веществу известному как турнбулева синь.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Наблюдение: (Отметьте цвет осадка)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) в пробирку поместите 2-3 капли раствора FeС13, добавьте каплю раствора гексацианоферрата (II) калия – K4[Fe(CN)6]. Напишите уравнение реакции, дайте химическое название полученному веществу известному как берлинская лазурь.
____________________________________________________________________________________________________________________________________________________________________________________________________________
Наблюдение: (Отметьте цвет осадка)
____________________________________________________________________________________________________________________________________________________________________________________________________________
в) в пробирку поместите 1-2 мл раствора FeС13, добавьте несколько капель KCNS]? Напишите уравнение реакции.
____________________________________________________________________________________________________________________________________________________________________________________________________________
Опишите наблюдения: (Какую окраску имеет полученное комплексное соединение K3[Fe(SCN)6)])
________________________________________________________________________________________________________________________________________
Выводы: (Сделайте вывод о возможности использования данных реакций для качественного обнаружения ионов Fe+2 и Fe+3 в растворах и биологических жидкостях)
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт №4. Исследование окислительных свойств перманганата калия.
Соединения Mn+7 для организма являются ядами так как они являются сильными окислителями и активно взаимодействуют с органическими и неорганическими веществами. Окислительные свойства KMnO4 широко используются в биохимическом анализе, для определения мочевой кислоты в крови, окисляемости воды и так далее. Реакция олеиновой кислоты с KMnO4 является примером такого взаимодействия и является качественной на двойные связи.
Методика эксперимента. В пробирку поместите 2 капли олеиновой кислоты, добавьте 2 капли раствора Na2CO3 и 2 капли раствора KMnO4. Встряхните пробирку несколько раз. Запишите реакцию взаимодействия перманганата калия с олеиновой кислотой С17Н33СООН.
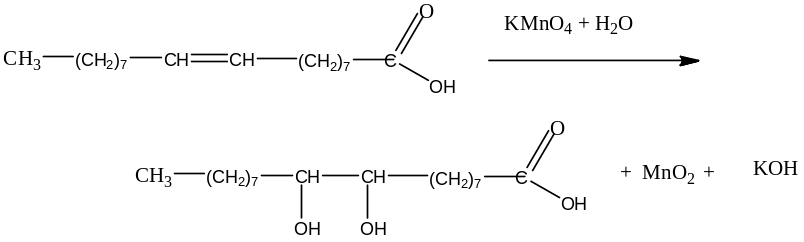
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Наблюдение: (Отметьте, какие изменения происходят с первоначальной фиолетовой окраской раствора)
____________________________________________________________________________________________________________________________________________________________________________________________________________
Сделайте вывод:
___________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт № 5 Исследование окислительных свойств бихромата калия.
Соединения Сr+6 являются для организма ядами, за счет своих окислительных свойств. Окислительные свойства его можно изучить на примере реакции с этиловым спиртом.
Методика эксперимента. В пробирку поместите 2 капли этилового спирта, добавьте каплю H2SO4 и 2 капли бихромата калия. Полученный оранжевый раствор нагрейте до начала изменения окраски и появления запаха уксусного альдегида (запах прелых яблок). Напишите уравнения реакции, укажите окислитель и восстановитель. Реакция используется для установления факта опъянения.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опишите наблюдения:
____________________________________________________________________________________________________________________________________________________________________________________________________________
Cделайте выводы об обнаружении (или отсутствии) этанола в исследуемом растворе:
____________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт № 6 Определение жесткости воды
Жесткость воды определяется присутствием в воде катионов кальция Ca2+ и магния Mg2+. Определение жесткости является одним из гигиенических показателей воды. Употребление жесткой воды в пищу не рекомендуется, поскольку катионы кальция Ca2+ и магния Mg2+образуют ряд нерастворимых солей (фосфаты, карбонаты, оксалаты), которые образуют почечные конкременты и являются причиной мочекаменной болезни.
Качественное и количественное определение катионов кальция Ca2+ и магния Mg2+ основано на образовании ими окрашенных комплексов в щелочной среде с индикаторами хромогеном черным (эриохромом) (Na2H In) и раствором двунатриевой соли этилендиаминтетрауксусной кислоты (Трилон Б, комплексон III).
С хромогеном черным образуются окрашенные комплексы красно-фиолетового цвета.
Na2H In + Mg2+ ↔ MgHIn + 2 Na+ красно-фиолетовый комплекс
Na2H In + Ca2+ ↔ CaHIn + 2 Na+
При последующем добавлении к красно-фиолетовому комплексу трилона Б комплексы с эриохромом разрушаются, раствор приобретает голубую окраску .
Na2H2 (комплексон III) + Ca2+ ↔ Na2Ca (комплексон III) + 2 H+ голубая окраска
Na2H2 (комплексон III) + Mg2+ ↔ Na2Mg (комплексон III) + 2 H+
Методика эксперимента.
В пробирку наливают 5-10 мл водопроводной воды, добавляют 1-2 кристаллика эриохрома черного (или 1-2 капли его раствора), 5 мл раствора аммиачного буфера, наблюдают появление окраски. К окрашенному буферу по каплям добавляют 0,1 М раствор трилона Б до перехода окраски в голубой цвет.
Наблюдения. ____________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы о наличии (или отсутствии) солей кальция и магния в исследуемой воде. ._________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы к защите работы:
1. Какие элементы относятся к d-семейству?
___________________________________________________________________________________________________________________________________________________________________________________________________________
2. В каких степенях окисления встречаются d-элементы в организме? Приведите примеры.
___________________________________________________________________________________________________________________________________________________________________________________________________________
3. Как называются комплексные соединения d-элементов с органическими лигандами?
____________________________________________________________________________________________________________________________________________________________________________________________________________
4. С какими веществами реагирует KMnO4, и эта реакция используется как качественная?
____________________________________________________________________________________________________________________________________________________________________________________________________________
5. Какие реакции используются для качественного обнаружения ионов Fe+3?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
