
- •1. Основные термодинамические параметры и уравнения состояния рабочего тела
- •2. Основные термодинамические функции
- •3. Теплоемкость газов
- •3.1. Основные определения
- •3.2. Истинная и средняя теплоемкости
- •3.3. Зависимость теплоемкости от характера процесса
- •4. Основные законы термодинамики
- •4.1. Первый закон
- •4.2. Второй закон
- •5. Процессы изменения состояния идеальных газов
- •5.1. Изохорный процесс
- •5.2. Изобарный процесс
- •5.3. Изотермический процесс
- •5.4. Адиабатный процесс
- •5.5. Политропный процесс
- •6. Круговые процессы
- •7. Реальные газы
- •7.1. Основные понятия
- •7.2. Водяной пар
- •7.3. Определение параметров воды и водяного пара
- •7.3.1. Параметры кипящей жидкости
- •7.3.2. Параметры сухого насыщенного пара
- •7.3.3. Параметры влажного насыщенного пара
- •7.3.4. Параметры перегретого пара
- •7.4. Общий метод расчета термодинамических процессов паров
- •8. Задания для курсовой работы
- •8.1. Расчет газового цикла
- •8.2. Расчет парового цикла
- •Библиографический список
- •Оглавление
5.1. Изохорный процесс
Изохорным процессом называется такое изменение состояния газа, при котором объем его не изменяется.
У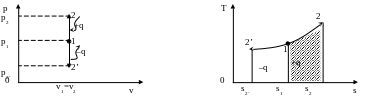 равнение
процесса v
= const.
равнение
процесса v
= const.
Рис.5.1. Изохорный процесс изменения состояния газа в р,v- и Т,s-диаграммах
Соотношение между
параметрами газа в процессе
![]() .
.
Изменение удельной
внутренней энергии
![]() .
.
Так как в изохорном
процессе удельный объем имеет постоянное
значение, то удельная работа изменения
объема
![]() .
.
Уравнение первого
закона термодинамики для процесса
![]() .
.
Изменение энтропии
для процесса
![]() .
.
5.2. Изобарный процесс
Изобарным процессом называется такое изменение состояния рабочего тела, при котором давление его остается постоянным.
У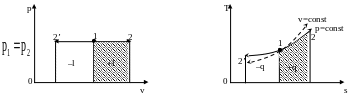 равнение
процесса p=const.
равнение
процесса p=const.
Рис.5.2. Изобарный процесс изменения состояния газа в р,v- и Т,s-диаграммах
Соотношение между
параметрами газа в процессе
![]() .
.
Изменение удельной
внутренней энергии в процессе
![]() .
.
Удельная работа
изменения объема
![]() .
.
Уравнение первого
закона термодинамики для процесса
![]() .
.
Изменение энтропии
для процесса
![]() .
.
5.3. Изотермический процесс
Изотермическим процессом называется такое изменение состояния рабочего тела, при котором температура его остается постоянной.
Уравнение процесса Т=const.
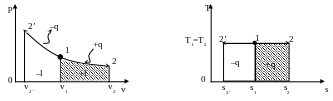
Рис.5.3. Изотермический процесс изменения состояния газа в р,v- и Т,s-диаграммах
Соотношение между
параметрами газа в процессе
![]() .
.
Изменение удельной
внутренней энергии в процессе
![]() .
.
Удельная работа
изменения объема
![]() .
.
Уравнение первого
закона термодинамики для процесса
![]() .
.
Изменение энтропии
для процесса
![]() .
.
5.4. Адиабатный процесс
Адиабатным называется процесс изменения состояния рабочего тела без подвода и отвода теплоты.
Уравнение процесса pvk=const,
где k
– показатель адиабаты – величина,
равная отношению удельной изобарной
теплоемкости к удельной изохорной
теплоемкости:
![]() .
Это отношение зависит от температуры
вещества, но для газов и паров эта
зависимость настолько незначительна,
что ею в расчетах часто пренебрегают,
принимая отношение k
величиной постоянной. Для идеальных
газов это отношение принимают равным:
одноатомных – 1,67; двухатомных – 1,40;
трех- и многоатомных – 1,29.
.
Это отношение зависит от температуры
вещества, но для газов и паров эта
зависимость настолько незначительна,
что ею в расчетах часто пренебрегают,
принимая отношение k
величиной постоянной. Для идеальных
газов это отношение принимают равным:
одноатомных – 1,67; двухатомных – 1,40;
трех- и многоатомных – 1,29.
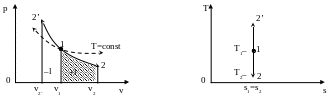
Рис.5.4. Адиабатный процесс изменения состояния газа в р,v- и Т,s-диаграммах
Соотношение между
параметрами газа в процессе
![]() .
.
Изменение удельной
внутренней энергии в процессе
![]() .
.
Удельная работа
изменения объема
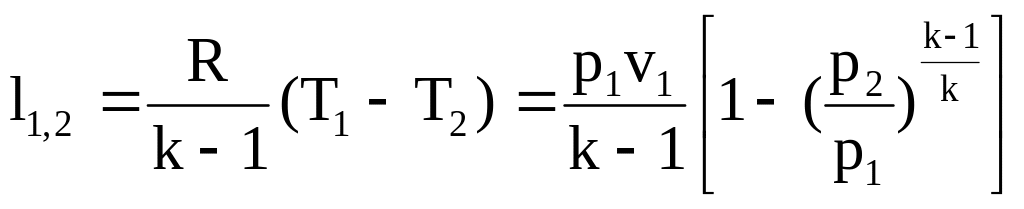 .
.
Уравнение первого
закона термодинамики для процесса
![]() .
.
Изменение энтропии
для процесса
![]() .
.
5.5. Политропный процесс
Политропными
процессами называют такие процессы,
при протекании которых теплоемкость
остается неизменной (c=const).
Политропные процессы подчиняются
уравнению
![]() ,
в котором показатель политропы n
может применять любые значения (от
,
в котором показатель политропы n
может применять любые значения (от
![]() до
до
![]() ),
в зависимости от значения n
будет изменяться и характер протекания
процессов. Ранее рассмотренные процессы
являются частными случаями политропных
процессов при определенных значениях
показателя политропы n.
),
в зависимости от значения n
будет изменяться и характер протекания
процессов. Ранее рассмотренные процессы
являются частными случаями политропных
процессов при определенных значениях
показателя политропы n.
При n
= k
уравнение
принимает вид
![]() – уравнение адиабатного процесса.
– уравнение адиабатного процесса.
При n
= 1 получаем
![]() – уравнение изотермического процесса
для идеального газа.
– уравнение изотермического процесса
для идеального газа.
При n
= 0 получаем
![]() – уравнение изобарного процесса.
– уравнение изобарного процесса.
При n
=
![]() уравнение политропы обращается в
уравнение
уравнение политропы обращается в
уравнение
![]() – уравнение изохорного процесса.
– уравнение изохорного процесса.
Показатель политропы
можно определить по двум заданным точкам
с известными параметрами:
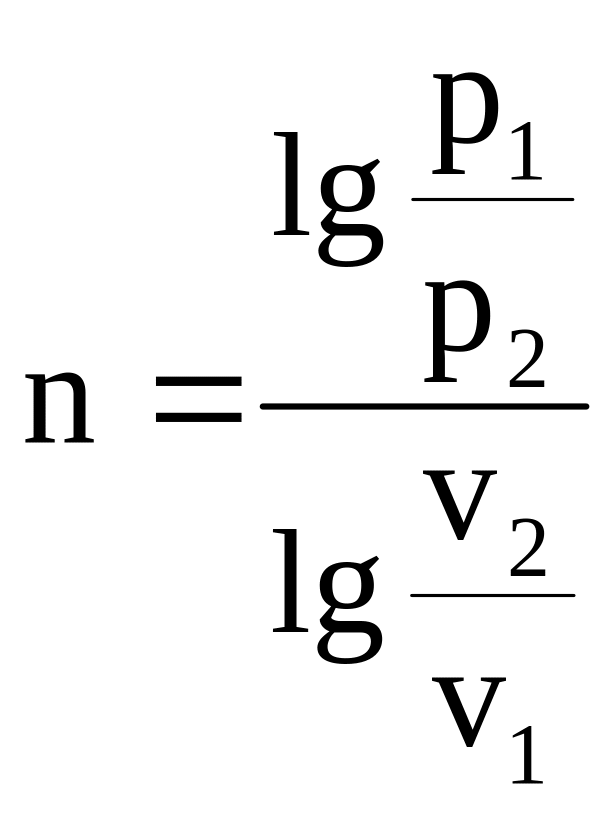 .
.
Соотношение между
параметрами газа в процессе
![]() .
.
Для идеальных
газов
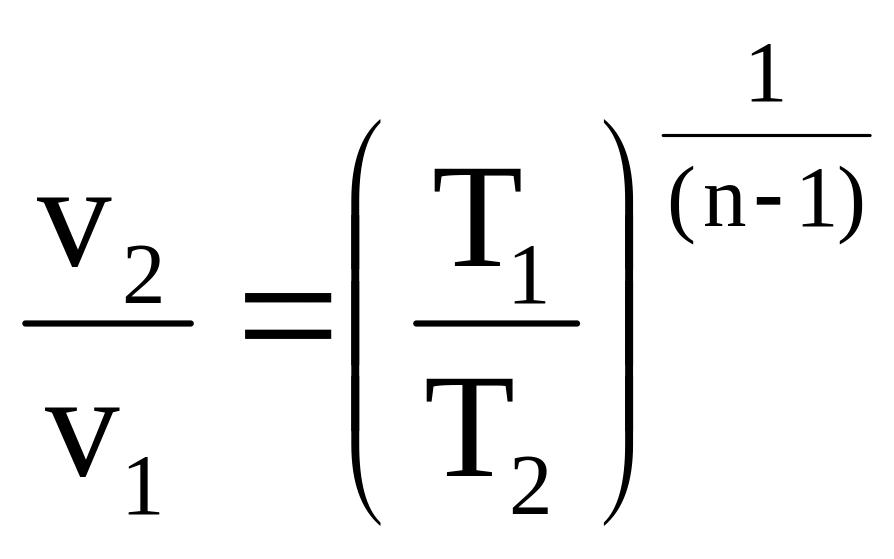 ,
,
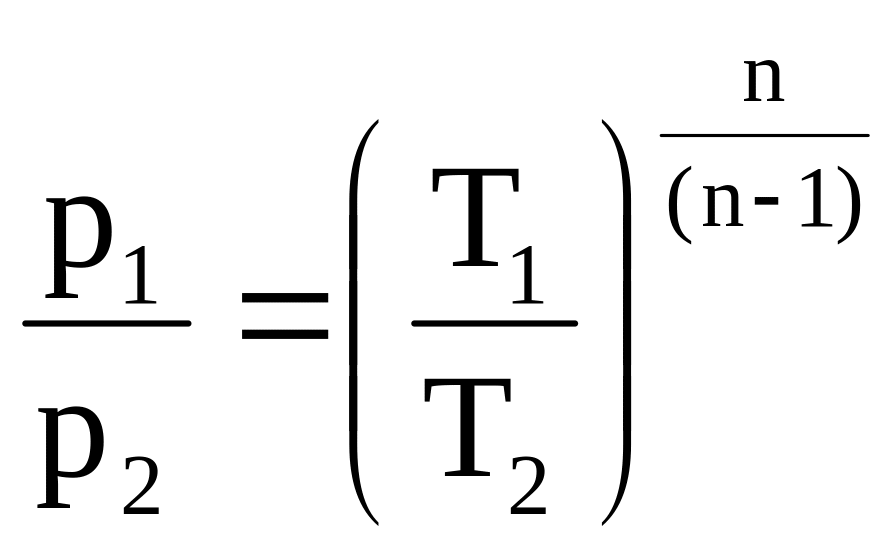 .
.
Изменение удельной внутренней энергии в процессе .
Удельная работа
изменения объема
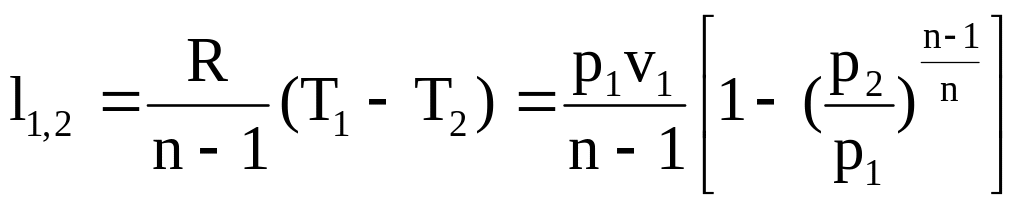 .
.
Уравнение первого
закона термодинамики для процесса
![]() .
.
Изменение энтропии
для процесса
![]() .
.
