
№ 1.1 Концентрация 2,3-бисфосфоглицерата в эритроцитах при хранении консервированной крови может уменьшаться с 8,0 до 0,5 ммоль/л. Можно ли переливать такую кровь тяжелобольным людям, если концентрации 2,3-бисфосфоглицерата восстанавливается не ранее чем через 3 суток? Для ответа поясните:
а) Что такое 2,3-бисфоглицерат
б) Когда и в каком участке он присоединяется к гемоглобину
в) Как изменяется сродство гемоглобина к О2 при присоединении 2,3-бисфосфоглицерата.
Кровь со сниженной концентрацией 2,3-БФГ нельзя переливать тяжелобольным людям, так как 2,3-БФГ необходим для снабжения тканей кислородом, а его концентрация восстанавливается не ранее, чем через 3 суток.
а) 2,3-бисфосфоглицерат (2,3-БФГ) – вещество, синтезируемое из промежуточного продукта окисления глюкозы – 1,3-бисфосфоглицерата.
б) В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров. Центральная полость – место присоединения БФГ.
В молекуле дезоксигемоглобина по сравнению с оксигемоглобином есть дополнительные ионные связи, соединяющие протомеры, поэтому размеры центральной полости больше в дезоксигемоглобине, следовательно 2,3-БФГ может присоединиться только к дезоксигемолглобину.
В тканях 2,3-БФГ присоединяется к дзоксигемоглобину и снижает сродство гемоглобина к кислороду.
лёгкие
в) HbO2 + 2,3-БФГ ↔ Hb*2,3-БФГ + O2
ткани
В результате взаимодействия 2,3-БФГ с дезоксигемоглобином образуется 5 дополнительных ионных связей, что снижает сродство гемоглобина в кислороду.
№ 1.2 Существует наследственное заболевание, связанное с изменением концентрации 2,3-бисфосфоглицерата в эритроцитах. Это вещество синтезируется из 1,3-бисфосфоглицерата при участии мутазы. Какое значение имеет 2,3-бисфосфоглицерат в регуляции сродства гемоглобина к О2? Для ответа на вопрос:
а) Укажите, в каком метаболическом пути синтезируется предшественник 2,3-бисфосфоглицерата. Напишите схему этого пути, подчеркните субстрат, используемый для синтеза 2,3-бисфосфоглицерата
б) Объясните, каков механизм регуляции сродства гемоглобина к О2 с помощью 2,3-бисфосфоглицерата
в) Уточните, как изменится количество доставляемого в ткани О2 при снижении синтеза 2,3-бисфосфоглицерата.
В тканях 2,3-БФГ присоединяется к дезоксигемоглобину и снижает сродство гемоглобина к кислороду.
а) Предшедственник 2,3-БФГ – 1,3-БФГ – синтезируется в гликолизе.

Субстрат – 1,3-бисфосфоглицерат.
лёгкие
б) HbO2 + 2,3-БФГ ↔ Hb*2,3-БФГ + O2
ткани
В результате взаимодействия 2,3-БФГ с дезоксигемоглобином образуется 5 дополнительных ионных связей, что снижает сродство гемоглобина в кислороду.
Центральная полость дезоксигемоглобина является местом присоединения 2,3-БФГ. 2,3-БФГ может присоединяться только к дезоксигемоглобину, так как центральная полость дезоксигемоглобина больше, чем оксигемоглобина за счёт дополнительных ионных связей.
в) При снижении синтеза 2,3-БФГ количество доставляемого в ткани кислорода снизится.
№ 1.3 Кислород необходим клеткам для процессов окисления веществ и получения энергии. Недостаток кислорода, так же как его избыток, губителен для тканей. Каким образом регулируется количество О2, доставляемого в ткани в соответствии с потребностями клеток в кислороде? При ответе объясните:
а) Что такое эффект Бора
б) Как связан этот эффект с метаболической активностью тканей; приведите примеры реакций, в которых выделяется СО2
в) Как изменится количество поступающего в ткани О2 при алкалозе
а) На связывание кислорода гемоглобином сильное влияние оказывает pH и CO2. Связывание CO2 и H+ снижает способность гемоглобина связывать O2.
В периферических тканях, с относительно низким значением pH и высокой CO2, сродство Hb к кислороду падает по мере связывания CO2 и H+.
В лёгочных капиллярах выделяется CO2 и соответственно увеличивается pH крови, что приводит к увеличению сродства Hb к O2.
Влияние величины pH и концентрации CO2 на связывание и освобождение O2 гемоглобином называется Эффектом Бора.
Hb + O2 ↔ HbO2
Ионная форма реакции объясняет влияние концентрации H+ на связывание O2 Hb-ион.
HHb+ + O2 ↔ HbO2 + H+
Уменьшение pH и увеличение H+ приводит к высвобождению O2 из HbO2.
б)

в) Алкалоз – увеличение CO2.
При увеличении CO2 сродство Hb к кислороду падает, следовательно, количество кислорода, поступающего в ткани, увеличится.
Ацидоз – увеличение H+
Увеличение H+ способствует освобождению кислорода, а увеличение кислорода стимулирует высвобождение H+
№ 1.4 В крови студента одной из африканских стран, поступившего в больницу по поводу одышки, головокружения, учащенного сердцебиения и болей в конечностях, при анализе крови были найдены эритроциты, имеющие форму серпа. Объясните причину развития данного заболевания. Для ответа на этот вопрос объясните:
а) Какое строение имеет гемоглобин А
б) Какие изменения в структуре белка привели к образованию патологической формы гемоглобина
в) Как называется такая форма гемоглобина
г) Почему изменяются форма и функция эритроцитов.
Заболевание – серповидноклеточная анемия.
а) Гемоглобин А состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем.
β-цепь Вал-Гли-Лей-Тре-Про-Глу-Глу-Лиз
б) В гемоглобине S мутантными оказались 2β-цепи, в которых Глу, высокомолекулярная отрицательно заряженная аминокислота в положении 6, была заменена Вал, содержащим гидрофобный радикал.
HbS 2β-цепь Вал-Гли-Лей-Тре-Про-Вал-Глу-Лиз
в) Гемоглобин S
г) В дезоксигемоглобине S имеется участок, комплиментраный другому участку таких же молекул, содержащему изменённую. В результате молекулы дезоксигемоглобина начинают слипаться, образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
Нарушение доставки кислорода в ткани вызывает боли и даже некроз клеток в данной области.
№ 1 При нагревании белков до 70 градусов, большинство из них теряет свою биологическую активность. Объясните, как связана структура белков с их функцией, что происходит с белком при нагревании? Какие еще факторы могут нарушить структуру и функцию белков? Укажите механизмы защиты структуры белков в клетках. При ответе представьте соответствующие графики и рисунки.
ДНК Первичная структура белка Вторичная структура белка Третичная структура белка Образование уникальной формы активного центра Избирательное связывание лигандов Специфическая функция белка
При нагревании происходит денатурация:
Денатурация белков — это разрушение их нативной конформации, вызванное разрывом слабых связей, стабилизирующих пространственные структуры, при действии денатурирующих агентов. Денатурация сопровождается потерей биологической активности белка.
Денатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
высокая температура (более 50 "С)
интенсивное встряхивание раствора
органические вещества (например, этиловый спирт, фенол и его производные). Для денатурации белков в биохимических исследованиях часто используют мочевину или гуанидинхлорид. Происходит разрыв связей, участвующих в формировании вторичной и третичной структуры нативных белков, и образование новых связей с химическими реагентами;

кислоты и щелочи, изменяют рН среды.
соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.)
детергенты – вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными).
Удаление денатурирующих агентов диализом приводит к восстановлению конформации и функции белка, т.е. к ренативации.
Молекулярные шапероны предотвращают денатурацию белков.
В клетках имеются белки – молекулярные шапероны, которые обладают способностью связываться с частично денатурированными, находящимися в неустойчивом, склонном к агрегации состоянии белками и восстанавливать их нативную конформацию.
Вначале эти белки были обнаружены как белки теплового шока, так как их синтез усиливался при стрессовых воздействиях на клетку, например при повышении температуры (индуцибельные шапероны), но существуют также и конститутивные шапероны, высокий базальный синтез которых не зависит от стрессовых условий.
Шапероны (Ш) классифицируются по массе субъединиц. Разлияают 6 классов:
Высокомолекулярные (100-110 кД)
Ш-90 (83-90 кД)
Ш-70 (60-78 кД)
Ш-60
Ш-40
Низкомолекулярные (15-30 кД)
Ш-70 способны защищать белки от температурной инактивации и восстанавливать конформацию и активность частично денатурированных белков.
Различные семейства шаперонов, обнаруженные практически во всех отделах клетки, участвуют в таких фундаментальных процессах, как:
ренативация частично денатурированных белков;
узнавание денатурированных белков и транспорт их в лизосомы;
синтез белков;
формирование трехмерной структуры белков;
сборка олигомерных белков;
транспорт белков через мембраны;
функционирование белковых комплексов и контроль за изменением между активной и неактивной конформацией.

№ 2 В популяции людей найдены около 300 полиморфных форм гемоглобина. Каковы причины и последствия полиморфизма гемоглобина? Для ответа на вопрос:
а) Расскажите строение основного белка эритроцитов;
б) Объясните, какие изменения в структуре гемоглобина могут привести к образованию полиморфных форм этого белка;
в) Используя в качестве примеров HbS и HbC, объясните, как изменение структуры 6елка отразится на его функции.
Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является усложнение генома в филогенезе и образование семейств родственных белков с близкой аминокислотной последовательностью и функциями или полиморфные разновидности одного и того же белка. Каждый индивидуум может иметь только два варианта любого белка, тогда как в популяции число вариантов может быть огромно (так, по всем аллелям НЬА популяция людей образует более 600 генетически различающихся групп). Полиморфизм белков настолько велик, что можно говорить о биохимической индивидуальности каждого человека.
а) Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем.
б) 2α2β 2α2δ HbA2
HbA + глюкоза HbA1c
2α2β 2α2γ HbF (фетальный)
2α2β 2ξ2ε HbE (эмбриональный)
В β-цепи в 6-м положении Глу (полярн) Вал (гидрофобн) HbS
В α- или β-цепи Гис E7 или Гис F8 Тир Fe 2+ окисляется в Fe3+ HbM (метгемоглобин)
Фен D1 (гидрофобн) Сер (гидрофильн) Hb Хаммерсмита
Гли B6 Арг Hb Ривердейла-Бронкса
Асп G1 Асн Hb Кемпси
в) В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.

В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
HbC, мутация происходит в β-цепи в 6 положении, Глу меняется на Лиз.
№ 3 HbS имеет информацию, отличную от информации НbА и хуже выполняет свою функцию. На примере этих белков объясните связь между первичной структурой и функцией белков. Приведите различные примеры проявления полиморфизма белков.
ДНК Первичная структура белка Вторичная структура белка Третичная структура белка Образование уникальной формы активного центра Избирательное связывание лигандов Специфическая функция белка.
Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем.
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Полиморфизм белков.
Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является усложнение генома в филогенезе и образование семейств родственных белков с близкой аминокислотной последовательностью и функциями или полиморфные разновидности одного и того же белка.
Другой важный пример полиморфизма белков, связанный с проблемой переливания крови, – существование в популяции людей 3 аллельных вариантов гена фермента гликозилтрансферазы (А, В и 0).
№ 4 В крови студента одной из африканских стран, поступившего в больницу с жалобами на одышку, головокружение, учащенное сердцебиение и боли в конечностях, при анализе крови были обнаружены эритроциты, имеющие форму серпа. Какова причина развития данного заболевания? Для ответа на вопрос:
а) Опишите строение основного белка эритроцитов и объясните, какие изменения в структуре привели к образованию патологической формы этого белка;
б) Используя таблицу генетического кода, определите, могут ли эти изменения быть результатом точечных мутаций;
в) Объясните, почему изменяется форма и функция эритроцитов.
а), в) Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем.
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
б) Эти изменения могут быть результатом точечных мутаций
№ 5 Кислород необходим клеткам для процессов окисления веществ и получения энергии. Недостаток кислорода, также как его избыток, губителен для тканей. Каким образом регулируется количество О2, доставляемого в ткани в соответствии с клеточными потребностями? При ответе объясните:
а) Что такое эффект Бора;
б) Как связан этот эффект с метаболической активностью тканей
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада – СО3 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3-

CO2 + H2O H2CO3 H+ + HCO3-
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α-амин о группам двух α-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
а) Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём. Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
б) В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О Н2СО3 Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани.
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3–
№ 2.1 У мужчины, который использовал инсектицид хлорофос для уничтожения колорадского жука на листьях картофеля, появились признаки отравления: головная боль, тошнота, и галлюцинации. Известно, что хлорофос является фосфоорганическим соединением. Опишите механизм действия фторфосфатов и объясните, почему хлорофос токсичен. Для этого:
а) Объясните, активность какого фермента в крови изменяется при отравлении этим инсектицидом; укажите механизм его действия
б) Напишите реакцию, скорость которой изменяет хлорофос.
а) Органические фторфосфаты типа диизопропилфторфосфата (ДФФ) являются ядами, потому что ковалентно связываются с остатком серина в активном центре ферментов, которые используют остаток серина для гидролитического расщепления.
Симптомы отравления органическими фторфосфатами связаны в основном с необратимым ингибированием фермента – ацетилхолинэстеразы (АХЭ)
Ацетилхолинэстераза ускоряет гидролиз ацетилхолина, функционирующего в качестве нейромедиатора. Продукты распада ацетилхолина – ацетат и холин – не способны действовать как нейромедиаторы. Увеличение количества ацетилхолина в синаптической щели при ингибировании АХЭ приводит к стойкой деполяризации постсинаптической мембраны и может вызвать паралич.
ДФФ и подобные фторфосфаты образуют ковалентную связь с остатком серина в активном центре АХЭ. Ингибирование является необратимым, и активность АХЭ восстанавливается только после синтеза новых молекул фермента.
б)

№ 2.2 Несколько лет назад в токийском метро террористы распылили одно из самых сильных отравляющих веществ – зарин. Многие пассажиры потеряли сознание, некоторые умерли в результате остановки дыхания. На чем основано нервно-паралитическое действие зарина?
а) Активность какого фермента и как изменится в крови при отравлении этим веществом
б) Напишите реакцию, скорость которой изменяет зарин.
а) Органические фторфосфаты типа диизопропилфторфосфата (ДФФ) являются ядами, потому что ковалентно связываются с остатком серина в активном центре ферментов, которые используют остаток серина для гидролитического расщепления.
Симптомы отравления органическими фторфосфатами связаны в основном с необратимым ингибированием фермента – ацетилхолинэстеразы (АХЭ)
Ацетилхолинэстераза ускоряет гидролиз ацетилхолина, функционирующего в качестве нейромедиатора. Продукты распада ацетилхолина – ацетат и холин – не способны действовать как нейромедиаторы. Увеличение количества ацетилхолина в синаптической щели при ингибировании АХЭ приводит к стойкой деполяризации постсинаптической мембраны и может вызвать паралич.
ДФФ и подобные фторфосфаты образуют ковалентную связь с остатком серина в активном центре АХЭ. Ингибирование является необратимым, и активность АХЭ восстанавливается только после синтеза новых молекул фермента.
б)
№ 2.3 Для лечения двигательных нарушений после травм, параличей, полиомелита используют препарат калимин, который по структуре похож на ацетилхолин. Как изменится концентрация ацетилхолина в нервно-мышечных синапсах после поступления нервного импульса при лечении калимином? Для ответа на вопрос:
а) Опишите влияние структурных аналогов субстратов на активность ферментов
б) Напишите реакцию гидролиза ацетилхолина и объясните ее значение для проведения нервного импульса.
После поступления нервного импульса при лечении калимином концентрация ацетилхолина увеличится.
а) Использование структурных аналогов является конкурентным ингибированием. В результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. С ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплекс фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется.
E + S → ES → E + P
E + I → EI
б)
Калимин является структурным аналогом ацетилхолина и ингибирует ацетилхолинэстеразу (АХЭ), катализирующую реакцию гидролиза ацетилхолина.
При добавлении ингибиторов активность ацетилхолина увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы использую при лечении мышечных дистрофий.
Холин и уксусная кислота не способны действовать как нейромедиаторы.
№ 2.4 Объясните, почему протеолитические ферменты и дезоксирибонуклеаза используются для лечения гнойных ран:
а) Какие реакции катализируют эти ферменты
б) Как изменится вязкость гнойного содержимого, если она зависит от концентрации макромолекул в его составе
в) Можно ли для очищения ран от гноя использовать пепсин, а также коллагеназу и гиалуронидазу.
а) Протеолитические ферменты расщепляют пептидные связи, образованные определёнными аминокислотами. К протеолитическим ферментам относятся пепсин, трипсин, химотрипсин.
Пепсин, химотрипсин, трипсин являются эндопептидазами, то есть действуют на пептидные связи, удалённые от концов пептидной цепи.
Дезоксирибонуклеаза (ДНК-аза) и рибонуклеаза (РНК-аза) панкреатического сока принимают участие в расщеплении нуклеиновых кислот. Они являются эндонуклеазами и гидролизуют макромолекулы до олигонуклеотидов.
б) Так как вязкость гнойного содержимого зависит от концентрации макромолекул в его составе, значит при дейсвтии протеолитических ферментов и ДНК-азы вязкость уменьшится.
в) Пепсин не используется для лечения гнойных ран, так как оптимум pH пепсина равен 1,0-2,5, что соответствует pH желудка, поэтому пепсин используется в зместительной энзимотерапии при ахимии, гипо- и -анацидных гастритах.
Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей (pH ~7,0).
Ферментные препараты РНК-азу и ДНК-азу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов.
Гиалуронидазу нельзя использовать для очищения ран от гноя. Она разрушает полисахаридные цепи. Из внеклеточного пространства гликозаминогликаны поступают в клетку по механизму эндоцитоза и заключаются в эндоцитозные пузырьки, которые затем сливаются с лизосомами. Лизосомальные гидролазы обеспечивают постепенное полное расщепление гликозаминогликанов до мономеров. В результате микроорганизмы попадают в межклеточное вещество, а затем в ткани организма, что приводит к гнойной инфекции. Гиалуронидаза используется для рассасывания рубцов подкожно и внутримышечно.
Коллагеназа используется в медицинской практике для лечения ожоговой болезни в хирургии и для лечения гнойных заболеваний глаз в офтальмологии. Существует два типа коллагеназ: 1. Тканевая коллагеназа участвует в катаболизме коллагена. 2. Бактериальная коллагеназа синтезируется некоторыми микроорганизмами. Расщепляет пептидную цепь коллагена более чем в 200 местах. Разрушаются соединительнотканные барьеры в организме человека, что обеспечивает инвазию микроорганизма и способствует возникновению и развитию газовой гангрены. Сам возбудитель не содержит коллагена и, поэтому не подвержен действию коллагеназы.
№ 2.5 На чем основано действие аспирина как жаропонижающего средства, лекарства, снимающего слабые боли и уменьшающего воспалительные процессы?
а) Напишите схему процесса, на который влияет аспирин
б) Укажите фермент, ингибитором которого является аспирин
в) В чем заключается причина изменения конформации молекул фермента при действии на нее аспирина, обратима ли инактивация фермента.
а) Аспирин является необратимым ингибитором синтеза эйкозаноидов.

При развитии воспалительных процессов увеличивается синтез большинства эйкозаноидов.
Эйкозаноиды – гормоны местного действия, вызывающие эффект по паракринному или аутокринному механизму через специфические рецепторы. Эйкозаноиды образуются во всех органах и тканях, а не в эндокринных железах
б) Аспирин является ингибитором циклооксигеназы.в
в) Ацетильный остаток переносится с молекулы аспирина на ОН-группу фермента и необратимо ингибирует его.

№ 2.6 Каптоприл – лекарственный препарат, конкурентный ингибитор карбоксидипептидилпептидазы. Напишите схематически реакцию, скорость которой уменьшает каптоприол, и объясните:
а) Концентрация какого вещества при этом уменьшается в крови
б) Почему это лекарство эффективно при некоторых формах гипертонической болезни
а) Концентрация ангиотензина-II
б) Капторприл – конкурентный ингибитор карбоксипептидазы, который ингибирует синтез ангиотензина-II. Ди- и -трипептидазы синтезируются в активной форме в клетках слизистой кишечника, где расщепляют ди- и -трипептидазы до аминокислот, причём дипептидазы действуют только на дипептиды.
№ 2.7 Обнаружено, что увеличение концентрации цАМФ облегчает состояние больных бронхиальной астмой. Укажите от активности каких ферментов зависит концентрация цАМФ в клетке, и ингибиторы какого из этих ферментов можно использовать в качестве лекарств для облегчения симптомов этой болезни? Для ответа на вопрос:
а) Напишите схему реакции, которая ускоряет ферментом, снижающим концентрацию цАМФ
б) Какое значение для клетки имеет этот фермент, и какой гормон в клетке является его активатором.
От активности аденилатциклазы и фосфодиэстеразы.
Ингибиторы фосфодиэстеразы.
а) Фермент фосфодиэстераза
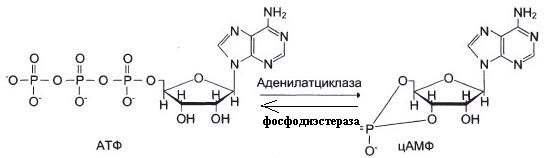

б) ФДЭ – фосфодиэстераза индуцируется в печени инсулином.
цАМФ активируеть ПКА (протеинкиназу А), которая:
1. Активирует ТАГ-липазу, которая участвует в мобилизации жира
2. Инактивирует гликогенсинтетазу и активирует гликофосфорилазу. В результате глюкоза поступает в кровь.
№ 2.8 При длительном приеме антибиотиков и сульфаниламидов происходит угнетение микрофлоры кишечника, участвующей в синтезе пиридоксина. Скорость каких реакций в клетках уменьшится и почему?
а) Напишите несколько реакций, для протекания которых необходим пиридоксин
б) Какое значение имеют эти реакции для организма человека?
а) Пиридаксин (витамин B6) является витамином0предшественником ПФ (пиридоксальфосфата).
ПФ участвует в трансаминировании и декарбоксилировании аминокислот. Также ПФ входит в состав гликогенфосфорилазы.
Трансаминированию подвергаются все аминокислоты кроме Лиз, Тре, Про.

Декарбоксилирование в синтезе биогенных аминов (нейромедиаторов)

б) Значение реакций трансаминирования:
1. Первая реакция на пути катаболизма большинства аминокислот
2. Последняя реакция на пути синтеза заменимых аминокислот
3. Таким образом происходит перераспределение азота между аминокислотами.
Значение реакций декарбоксилирования:
Причиной паркинсонизма является недостаточность дофамина в чёрной субстанции мозга. Это может быть вызвано снижением активности тирозингидроксилазы и ДОФА-декарбоксилазы.
№ 3.1 Весной у многих людей развивается гиповитаминоз, обусловленный снижением в пище количества витаминов В1, В2, РР. Наиболее характерными признаками этих гиповитаминозов являются сонливость и повышенная утомляемость.
а) Почему дефицит витамина РР может привести к таким состояниям
б) Для объяснения представьте схемы метаболических путей, в которых принимает участие витамин РР
в) Почему дефицит витамина В2 может привести к описанным состояниям
г) Для объяснения представьте схемы метаболических путей, в которых принимает участие витамин В2
д) Почему дефицит витамина В1 может привести к таким состояниям? Представьте схемы метаболических путей, для которых необходим витамин В1
е) Для объяснения представьте схемы метаболических путей, в которых принимает участие витамин В1.
а), б) Витамин PP – предшественник кофермента NAD+, который участвует в 1. Функционировании ПДК (пируватдегидрогеназного комплекса)

