
Билет1
2. Первичная структура — это последовательность ковалентно связанных пептидными связями аминокислот, составляющих белок. Эта последовательность, записывается, начиная с N- конца полипептидной цепочки. Первой первичной структурой, которая была расшифрована, была последовательность аминокислот в полипептидных цепях гормона инсулина. Если в состав белка входит несколько полипептидных цепей, то их предварительно разъединяют, используя специальные реактивы. Для определения первичной структуры отдельной полипептидной цепи, методами гидролиза с использованием аминокислотных анализаторов, устанавливают ее аминокислотный состав. При гидролизе белка происходит разрушение первичной структуры белка.
3. При добавлении щелочи или кислоты к белку, выпавшему в осадок в изоэлектрическом состоянии, наступает перезарядка его молекул, и белок вновь переходит в раствор – растворяется. Белки сильно различаются по своей растворимости в водных системах. При растворении белков в воде вокруг их молекул образуется гидратная оболочка, которая наряду с зарядом белковых частиц является фактором устойчивости белковых растворов. На растворимость белков существенное влияние оказывают следующие факторы: а) рН, б) ионная сила, в) диэлектрические свойства растворителя и г) температура. . Денатурация белков сопровождается изменением их физико-химических свойств. Снижается растворимость, гидрофильность белка, его вязкость, оптические свойства.
4. Реакции на ароматические аминокислоты (реакции нитрования) При нагревании раствор и осадок окрашивается в ярко-желтый цвет, осадок при этом постепенно растворяется (происходит гидролиз белка).
Реакция Фоля- в белке присутствуют аминокислоты цистина и цистеина. Аминокислоты под влиянием щелочи при темпер. Разруш-ся с образованием H2S.
Реакция Адамкевича- в рез-те реакции обнаруж-ся амин триптофан.
Биуретовая реакция- в щелочной среде в присутствии ионов сульф.меди образ. Ионы меди с пептидной групп-ой сине-фиолетового цвета.
Реакция Миллона- белок сод-ит тирозин, т.к. выпадает белый осадок. В рез-те нагрев. Осадок меняет цвет, это обусловлено наличием ртутной соли нитропроизводного тирозина.
5.1983. Уотсен Крик
Билет2
2. Вторичная структура белка — способ скручивания полипептидной цепи в пространстве (за счет водородной связи между водородом амидной группы — NH — и карбонильной группы — СО —, которые разделены четырьмя аминокислотными фрагментами). Вторичной структурой обладает большая часть белков, правда, не всегда на всем протяжении полипептидной цепи. Известны три типа вторичной структуры: α-спираль, β-складчатый слой и беспорядочный клубок. α-Спираль — это спиральное строение в виде винтовой лестницы, где каждая ступень — определенная аминокислота. Витки спирали соединены между собой непрочными водородными связями. Обеспечивается водородными связями — С=О...H-N—, возникающими между карбонильным кислородом и иминным азотом, принадлежащим к той же самой полипептидной цепи. В β-складчатом слое 2 или более полипептидных цепи; сложены зигзагом так, что их сегменты находятся вблизи друг от друга в параллельной или антипараллельной ориентации, причем соседние сегменты соединены водородными связями. Беспорядочный клубок — участки, которые нельзя отнести ни к α-спирали, ни к β-складчатому слою.
3.Физико-химические свойства белков: Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление Для белков рас-ов хар-на: вязкость , представляет собой коллоид. Не проходят ч-з полупрн.мембрану. белки осаждаются различными солями и растворами. Для обнаружения белков в растворе применяются: цветные реакции, реакции осаждения.
Денатурация- распад и потеря пространственной структуры белка. Потеря нативной комформации белка.
Нативная комформация- структура белка которая помогает ему выполнять ему свою физиологическую функцию.
4.
РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ-
a-Аминокислоты реагируют с нингидрином,
образуя сине-фиолетовый комплекс (пурпур
Руэманна), интенсивность окраски которого
пропорциональна количеству аминокислоты.
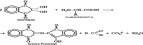
РЕАКЦИЯ С ФОРМАЛЬДЕГИДОМ
При взаимодействии a-аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:

Эта реакция лежит в основе количественного определения a-аминокислот методом формального титрования (метод Сёренсена)
КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a-аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет.
5. Рибонуклеи́новая кисло́та (РНК) — одна из трёх основных макромолекул которые содержатся в клетках всех живых организмов. функции РНК различаются в зависимости от вида рибонуклеиновый кислоты. 1) Информационная РНК (и-РНК). называют матричной РНК (м-РНК). располагается как в ядре, так и в цитоплазме клетки. Основное назначение – перенос информации о строении белка от ДНК к рибосомам, где и происходит сбор белковой молекулы. 2) Рибосомная РНК (р-РНК). Р-РНК расположена в рибосомах и является матрицей для синтеза белковых молекул. 3) Транспортная РНК (т-РНК). в цитоплазме клетки. - осуществление транспорта (переноса) аминокислот к месту синтеза белка (в рибосомы).
Билет3.
2. СnH2n+1-CH(NH2)-COOH-общая формула. Протеиногенными называются 20 аминокислот, которые кодируются генетическим кодом (см. с. 244) и включаются в белки в процессе трансляции.
Классификация:По радикалу
Неполярные: глицин, аланин, валин, триптофан
Полярные незаряженные : серин, треонин, цистеин, аспарагин, глутамин, тирозин
Полярные заряженные отрицательно: аспартат, глутамат
Полярные заряженные положительно: лизин, аргинин, гистидин
По функциональным группам
Алифатические
Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
Оксимоноаминокарбоновые: серин, треонин
Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
Амиды моноаминодикарбоновых: аспарагин, глутамин
Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
Гетероциклические: триптофан, гистидин, пролин
Dаминокислоты- открыты в клеточной стенке бактерий; в составе некоторых антибиотиков,
Подавляющее большинство a-аминокислот, встречающихся в природе, относится к L-ряду. Их энантиоморфы, т.е. D-аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами. D-аминокислоты в природе редки; они встречаются в некоторых антибиотиках и клеточной оболочке бактерий.
3. Последовательность выделения белков: измельчение биологического материала (гомогенизация): извлечение белков, (экстракция); выделение исследуемого белка из смеси других белков, т.е. очистка и получение индивидуального белка.
гомогенизация - Перед выделением белков из биологических объектов (органы и ткани животных, микроорганизмы, растения) исследуемый материал тщательно измельчают до гомогенного состояния, т.е. подвергают дезинтеграции вплоть до разрушения клеточной структуры. Используют замораживания и оттаивания ткани, в основе действия которого лежит разрушение клеточной оболочки, вызванное кристаллами льда.
4. Отделение альбуминов от глобулинов в сыворотке крови. Альбумины и глобулины широко распространены в природе. Альбумины и глобулины растворимы в слабых растворах нейтральных солей, щелочей и кислот. Альбумины, в отличие от глобулинов, растворяются в чистой воде. Глобулины в воде не растворяются. Одним из методов выделения альбуминов и глобулинов из растворов является высаливание. глобулины выпадают из раствора при полунасыщении сернокислым аммонием в отличие от альбуминов. Это связано с тем, что у глобулинов больше молекулярная масса, чем у альбуминов. Альбумины высаливаются при такой же концентрации поваренной соли и сернокислого магния как и глобулины, но в отличие от глобулинов осадок альбуминов выпадает только при подкислении раствора.
5. Первичная структура ДНК - ДНК состоит из нуклеотидных цепей, у которых скелетную основу составляют чередующиеся сахарные и фосфатные группы, объединенные ковалентными скелетными связями, а боковые группы и присоединяются одна к другой молекулой сахара. Последовательно располагающиеся нуклеотиды ковалентно связаны фосфодиэфирными связями между сахарным остатком и фосфатом, и в результате этого объединены в полинуклеотидную цепь. Таким образом, первичная структура ДНК (как и РНК) определяется последовательностью нуклеотидов и характером их связей между сахарным остатком и фосфатом.
