
- •1. Введение
- •2. Строение гладкомышечной клетки
- •2.1. Сократительные белки
- •3. Иннервация гладкой мышцы. Рецепторы
- •3.1. Мультиунитарные и унитарные гладкие мышцы
- •3.2. Симпатическая иннервация. Адренорецепторы
- •3.3. Парасимпатическая иннервация. Холинорецепторы
- •3.4. Комедиаторы
- •3.5. Роль других биологически активных веществ
- •4. Механизмы функционирования гладкомышечной клетки
- •4.1. Механизмы возбуждения
- •4.1.1. Особенности потенциала действия
- •4.1.2. Спонтанная электрическая активность
- •4.1.3. Сокращение гладкой мышцы без потенциала действия
- •4.2. Механизм сокращения
- •4.2.1. Образование поперечных мостиков
- •4.3. Сопряжение процессов возбуждения и сокращения. Роль ионов кальция
- •4.3.1. Электромеханическое сопряжение
- •4.3.2. Фармакомеханическое сопряжение
- •4.4. Механизм расслабления
- •4.5. Регуляция сокращения
- •5. Заключение
- •Список литературы
4.2. Механизм сокращения
Аналогично другим типам мышц, повышение концентрации ионов Са2+ в саркоплазме является ключевым моментом в инициации сокращения. Регуляторные белки, которые контролируют процесс сокращения могут находиться либо в цитоплазме, либо на тонком или толстом филаментах. В зависимости от расположения Са-связывающих белков различают актиновый и миозиновый тип регуляции сокращения. Актиновый тип регуляции характерен для сердечной и поперечно-полосатой мышцы, а миозиновый тип регуляции сокращения характерен только для гладкомышечной клетки [210, 324].
Ионы Са2+, попадая в саркоплазму, связываются со специфическим регуляторным белком кальмодулином (аналогом тропонина С), который содержит в своей структуре четыре Са-связывающих участка. Связывание кальмодулина с ионами Са2+ вызывает конформационные изменения структуры кальмодулина, в результате которых комплекс Са-кальмодулин активирует киназу легких цепей миозина [207, 344]. Это фермент из группы протеинкиназ, который способен переносить остаток фосфата АТФ на оксигруппы остатков серина или треонина белка. В покоящейся клетке киназа легких цепей миозина не активна. Причиной отсутствия активности является специальный ингибиторный участок, который закрывает активный центр фермента, тем самым блокируя его активность (рис.12). Активность киназы легких цепей миозина повышается в присутствии ионов Са2+ [151, 207, 247].
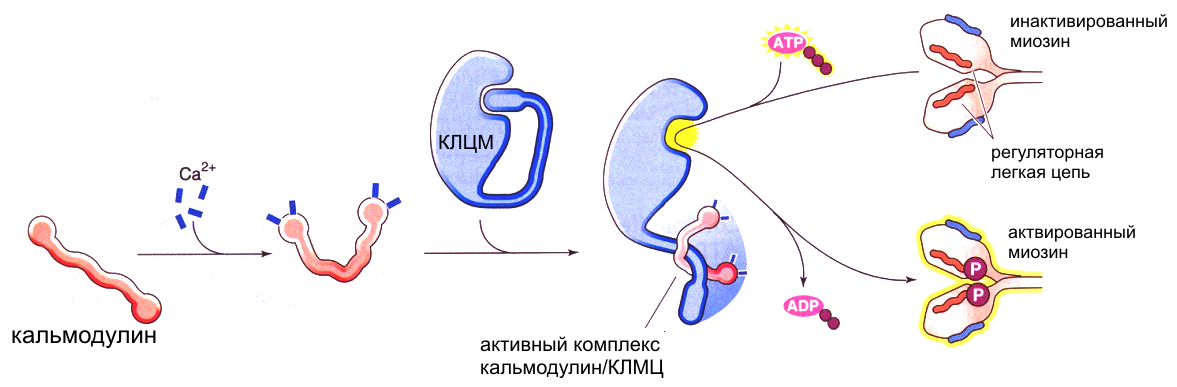
Рис. 12. Схема активации киназы легких цепей миозина (КЛЦМ) и фосфорилирования легких цепей миозина при помощи комплекса Са-кальмодулин.
В последующем киназа легких цепей миозина переносит молекулу фосфата от АТФ на один или два остатка серина регуляторной легкой цепи миозина. Фосфорилирование приводит к структурным изменениям как самой легкой цепи, так и тяжелой цепи в области ее контакта с легкой цепью. Следствием конформационных изменений является значительное повышение АТФ-азной активности миозина, что приводит к взаимодействию миозина с актином. В отличие от скелетной мышцы, в которой АТФ-азная активность миозина довольно высока постоянно, в гладкой мышце сокращение не может начаться до тех пор, пока киназа легких цепей миозина не повысит АТФ-азную активность миозина. В некоторых случаях фосфорилирование легких цепей миозина в слабой степени наблюдается и в отсутствии внешнего стимула. После фосфорилирования легкой цепи миозин взаимодействует с актином, реализуя процесс мышечного сокращения (рис.13).
4.2.1. Образование поперечных мостиков
В состоянии физиологического покоя концентрация внутриклеточного Ca2+, фосфорилирование легких цепей миозина, АТФ-азная активность миозина и уровень образования поперечных мостиков весьма малы. В покое только очень небольшое количество поперечных мостиков может связывать сократительные белки, обеспечивая слабое тоническое сокращение. АТФ-азная активность миозина в покое низка, но не равна нулю. При активации клетки увеличивается внутриклеточная концентрация ионов Ca2+, что инициирует цикл образования поперечных мостиков, который включает в себя 5 стадий.
Исходное состояние: головка миозина связана с нитью актина после того, как в ходе предыдущего цикла был освобожден аденозин монофосфат. В отсутствие АТФ система может оставаться в таком устойчивом, «ригидном» состоянии в течение достаточно длительного периода времени. В этом ригидном состоянии головка миозина образует угол в 450 по отношению к актиновым и миозиновым миофиламентам.
1 этап. АТФ связывается с головкой тяжелой цепи миозина, в результате чего уменьшается сродство миозина к актину и головка миозина освобождается. Если все поперечные мостики мышцы находятся в данной стадии, то мышца полностью расслаблена.
2 этап. Распад АТФ до АДФ и неорганического фосфата происходит на головке миозина и продукты гидролиза удерживаются на миозине. В результате гидролиза головка миозина поворачивается вокруг шарнирного участка, занимая приподнятое положение (под углом в 900) по отношению к нитям актина и миозина. Этот поворот вызывает сдвиг головки миозиновой нити приблизительно на 11нм вдоль нити актина таким образом, что в данный момент головка миозина располагается напротив нового миозин-связывающего участка актиновой нити.
3 этап. В следующий момент времени приподнятая головка миозина связывается с нитью актина. Это связывание отражает повышенную степень сродства комплекса миозин-АДФ-неорганический фосфат к актину. Образование комплекса с актином вызывают структурные изменения в головке миозина, в результате которых из активного центра освобождается неорганический фосфат, образованный при гидролизе АТФ.
4 этап. Диссоциация неорганического фосфата от головки миозина приводит к гребковому движению. Это конформационное изменение, при котором головка миозина сгибается в области шарнирного участка приблизительно на 450 и сдвигает нить актина на 11 нм по направлению к хвосту молекулы миозина. В результате нить актина движется вдоль нити миозина.
5 этап. Завершается цикл диссоциацией АДФ от миозинового филамента и акто-миозиновый комплекс остается в исходном, ригидном состоянии. Головка миозина остается в том же положении, т.е. под углом в 450 по отношению к нити актина и миозина. Свободный от АДФ, миозин представляет из себя связанный с актином комплекс до тех пор, пока он не свяжется с другой АТФ, что приведет к образованию нового комплекса [1, 3, 73, 74, 97, 218, 221, 264, 293].
Исходное состояние акто-миозинового комплекса быстро связывает АТФ в концентрации, которая обычно наблюдается в клетке. И если не остановить, цикл образования поперечных мостиков будет продолжаться, пока не возникнет истощения АТФ в цитоплазме [105, 342, 378].
Гладкомышечные клетки могут контролировать цикл образования поперечных мостиков на втором этапе, предотвращая гидролиз АТФ в момент повышения АТФ-азной активности головки миозина [97, 126, 140, 143]. В скелетной и сердечной мышце цикл образования поперечных мостиков контролируется на третьем этапе, путем предотвращения образования поперечных мостиков в момент смещения тропомиозина при повышении внутриклеточной концентрации ионов Са++. Схема образования поперечных мостиков является общей для скелетной, сердечной и гладкой мышцы, однако частота циклов в гладкой мышце составляет менее одной десятой от частоты циклов, наблюдаемых в скелетной мышце. Это обусловлено различиями в свойствах изоформ миозина, встречающихся в гладких мышцах. Наряду с меньшей частотой образования циклов поперечных мостиков, гладкая мышца развивает силу равную или несколько большую, чем скелетная. Возможно, это происходит благодаря тому, что поперечные мостики остаются интактными в каждом цикле более длительное время. Вероятнее всего, длительный период, в течение которого поперечные мостики остаются интактными, связан с низкой скоростью освобождения АДФ от изоформы миозина, характерной для данной гладкой мышцы [18, 140, 248, 286, 309].
Гладкомышечная клетка сокращается гораздо медленнее, чем поперечно-полосатая. Это связано с тем, что в гладкой мышце имеется особая изоформа АТФазы миозина, для которой характерна довольно низкая максимальная активность (приблизительно в 10-100 раз ниже, чем активность АТФазы миозина скелетной мышцы). Видимо, это также является причиной малой утомляемости гладкой мышцы при продолжительной работе [74, 244].
Для того, чтобы остановился циклический процесс образования мостиков между актином и миозином, необходимо удалить фосфатный остаток с регуляторной легкой цепи миозина. Это происходит с участием другого фермента – фосфатазы легких цепей миозина. После активации фосфатазы легких цепей миозина с регуляторной легкой цепи миозина удаляются остатки фосфата. Дефосфорилированный миозин не способен осуществлять взаимодействие с нитями актина и наступает процесс расслабления [309]. В основном образование поперечных мостиков регулируется фосфорилированием регуляторной легкой цепи миозина. Однако в последнее время обнаружено существование дополнительного регуляторного механизма с участием ряда белков: тропомиозина, кальдесмона, кальпонина и SM22 [218]. Два протеина – кальдесмон и кальпонин – ингибируют взаимодействие между актином и миозином. Оба являются Са2+-кальмодулин связывающими белками и оба связаны с актином и с тропомиозином. Кальпонин, связанный с тропомиозином и с актином, ингибирует АТФ-азную активность миозина [49, 229, 242, 365, 366, 367, 368]. Активация комплекса Са2+-кальмодулин, кроме активации киназы легких цепей миозина, оказывает на кальпонин двойное действие: 1) может связывать кальпонин; 2) активировать Са2+-кальмодулин зависимую протеинкиназу, которая фосфорилирует кальпонин. Оба эффекта комплекса Са2+-кальмодулин в конечном итоге уменьшают ингибирование кальпонином АТФ-азной активности миозина. Аналогично кальпонину, кальдесмон ингибирует АТФ-азную активность миозина в гладкой мышце [12, 38, 55, 195, 199, 322, 346]. Интересно отметить, что кальдесмон подавляет сократимость миометрия в период беременности и внутриклеточный уровень кальдесмона в этот период в миометрии довольно высокий, в то время как во время родов его уровень значительно падает. Это может иметь большое практическое значение для предотвращения преждевременных родов [267, 373]. Следствием понижения концентрации ионов Са2+ в цитоплазме является диссоциация ионов Са2+ из катионсвязывающих центров кальмодулина. В дальнейшем кальмодулин диссоциирует от киназы легких цепей миозина, которая сразу же становится неактивной под влиянием своего же собственного ингибиторного участка [218].
