
- •Раздел 2
- •Глава 11
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием Расчёты, связанные с приготовлением растворов
- •Расчёты, связанные с титрованием
- •Глава 13
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •Метиловый красный
- •Тимолфталеин (бесцветный синий)
- •Феноловый красный
- •13.3. Кривые титрования
- •0,10 М раствором NaOh
- •Расчёты для построения кривой титрования
- •Расчёты для построения кривой титрования
- •0,10 М Na2co3 0,10 м раствором hCl
- •13.4. Факторы, влияющие на величину скачка титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.2. Критерии выбора растворителя для кислотно-основного титрования
- •14.3. Применение в фармацевтическом анализе Титрование в кислотных растворителях
- •Глава 15
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •1,010-3 М раствором эдта при рН 9,50 в присутствии 510-2 м nh3
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •Пирокатехиновый фиолетовый – металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •Глава 16
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •Расчёты для построения кривой титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •Метод Мора
- •Метод Фольгарда
- •Особенность определения хлоридов
- •Особенность определения иодидов
- •Метод Фаянса
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
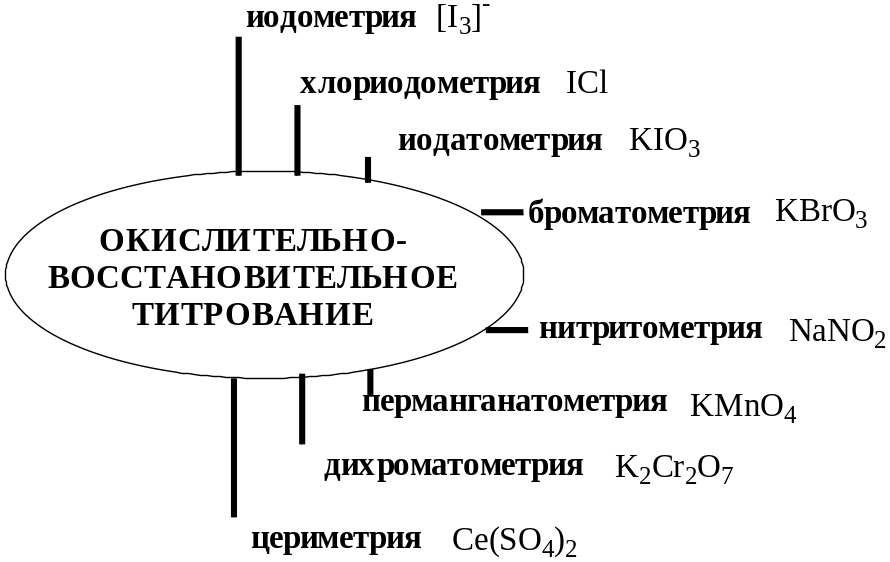
- •18.1. Иодометрическое титрование
- •Титранты и стандартные вещества
- •Обнаружение конечной точки титрования
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
Глава 17
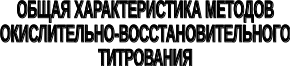
17.1. Общая характеристика и классификация
Окислительно-восстановительным титрованием называется группа титриметрических методов анализа, основанных на использовании окислительно-восстановительных реакций.
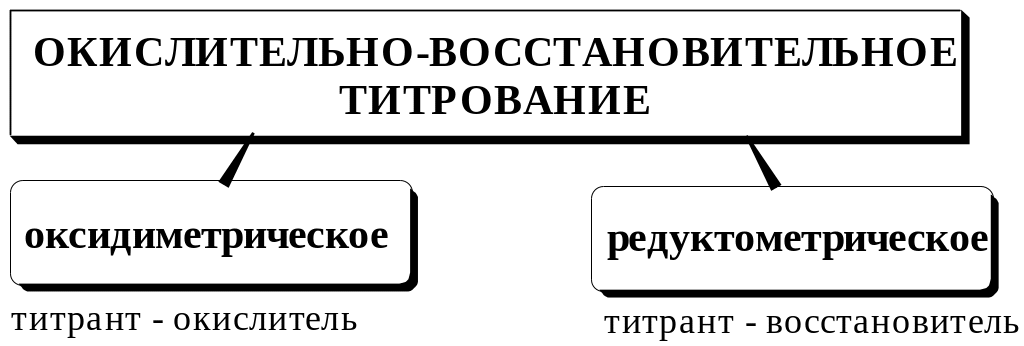
Оксидиметрические методы титрования используются, особенно в фармацевтическом анализе, значительно чаще, чем редуктометрические. Недостатком применения сильных восстановителей в качестве титрантов является то, что их стандартные растворы необходимо защищать от кислорода воздуха, а титрование проводить в атмосфере инертного газа.
Вещества, используемые в качестве титрантов в окислительно-восстановительном титровании, должны быть сильными окислителями и восстановителями, а величина ЭДС реакции такой, чтобы реакция между определяемым веществом и титрантом протекала количественно.
Как и в случае других титриметрических методов анализа:
титрант должен реагировать только с определяемым веществом, и реакция между ними должна протекать стехиометрично;
реакция, используемая в прямом титровании, должна протекать с приемлемой скоростью и, кроме того, должен существовать способ обнаружения конечной точки титрования.
В фармацевтическом анализе наиболее часто используются следующие методы окислительно-восстановительного титрования.
Определяемое вещество может находиться в анализируемом объекте в нескольких степенях окисления, например, Fe(II) и Fe(III) или As(III) и As(V). Перед проведением титрования его необходимо перевести в одну степень окисления, которая реагирует с применяемым титрантом. Для этого образец обрабатывают реагентом, являющимся более сильным восстановителем или окислителем, чем определяемое вещество, и который затем можно будет легко удалить из раствора. В качестве реагентов-восстановителей используют различные металлы (цинк, кадмий и др.) и их амальгамы, а также гидразин, сероводород и т.д. В качестве реагентов, используемых для предварительного окисления определяемых веществ, используют пероксид водорода, персульфат аммония и некоторые другие вещества.
17.2. Кривые титрования
Кривая титрования в окислительно-восстановительном титровании представляет собой зависимость электродного потенциала системы от степени оттитрованности.
Пусть при титровании протекает химическая реакция
n2Red1 + n1Ox2 n2Ox1 + n1Red2,
в которой Red1 – определяемое вещество, Ox2 – титрант.
![]()
![]()
В
процессе титрования после добавления
каждой очередной порции титранта в
системе будет устанавливаться химическое
равновесие, при котором
![]() .
Величина электродного потенциала,
которая устанавливается при таком
равновесии, называется электродным
потенциалом системы.
При построении кривой титрования
величину потенциала удобнее рассчитывать
для того вещества, которое в данных
условиях находится в избытке: до точки
эквивалентности – это титруемое
вещество, после точки эквивалентности
– титрант.
.
Величина электродного потенциала,
которая устанавливается при таком
равновесии, называется электродным
потенциалом системы.
При построении кривой титрования
величину потенциала удобнее рассчитывать
для того вещества, которое в данных
условиях находится в избытке: до точки
эквивалентности – это титруемое
вещество, после точки эквивалентности
– титрант.
Рассмотрим титрование 1,010-2 М Fe2+ 1,010-2 М раствором Ce4+, протекающее в 1 М H2SO4. Величины формальных потенциалов для Fe3+/Fe2+ и Ce4+/Ce3+ в данных условиях равны, соответственно +0,68 и + 1,44 В. Формулы для расчёта электродного потенциала системы в различных точках кривой титрования и рассчитанные по ним значения E приведены в табл. 17.1. Сама кривая титрования показана на рис. 17.1.
Табл. 17.1
Расчёты для построения кривой титрования 1,010-2 М Fe2+
1,010-2 М раствором Ce2+в 1 М H2SO4
f |
Расчётная формула |
E, В |
0,10 |
|
0,62 |
0,50 |
аналогично |
0,68 |
0,90 |
аналогично |
0,74 |
0,99 |
аналогично |
0,80 |
0,999 |
аналогично |
0,86 |
1,00 |
|
1,06 |
1,001 |
|
1,26 |
1,01 |
аналогично |
1,32 |
1,10 |
аналогично |
1,38 |
1,50 |
аналогично |
1,42 |
Из-за того, что концентрация окисленной формы определяемого вещества, если само оно является восстановителем, либо, наоборот, его восстановленной формы, если определяемое вещество – окислитель, в нулевой точке неизвестна, кривые окислительно-восстановительного титрования начинают строить с некоторого ненулевого значения f.
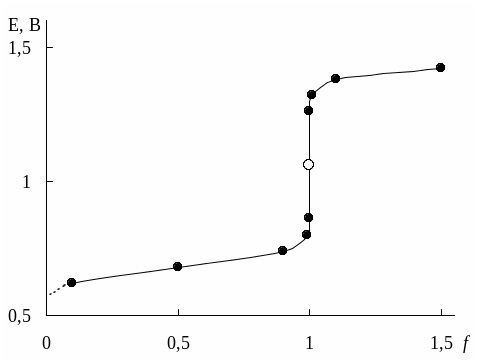
Рис. 17.1. Кривая титрования 1,010-2 М Fe2+1,010-2 М Ce4+в 1 М H2SO4
В точке эквивалентности обе полуреакции с точки зрения их использования для расчёта величины электродного потенциала системы оказываются равноценными.
![]()
![]()
![]()
![]() ,
,
![]()
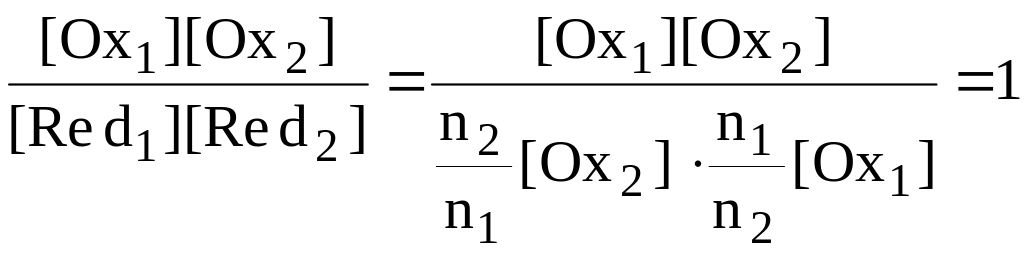
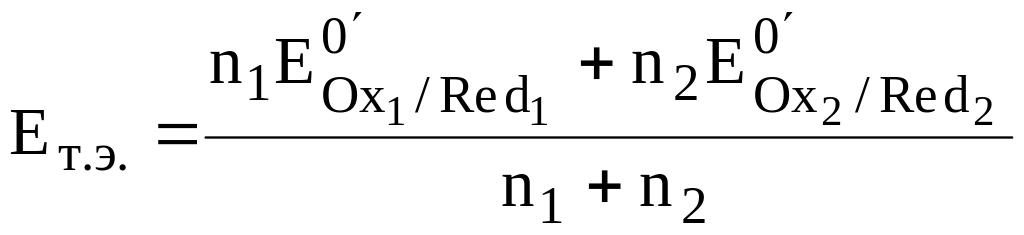
Для рассматриваемого случая n1 = n2 = 1, поэтому
![]()
Точка эквивалентности в рассматриваемом случае титрования находится в середине скачка титрования. Если число электронов, принимающих участие в двух полуреакциях, неодинаково, то величина потенциала системы в точке эквивалентности будет ближе к величине стандартного потенциала той полуреакции, в которой участвует больше электронов.
Полученная нами формула для расчёта Ет.э. не является универсальной и подходит лишь для тех случаев, когда в полуреакциях не принимают участие ионы H3O+ (либо их концентрация считается равной 1 моль/л), и не изменяется число частиц, являющихся окислителем или восстановителем.
Величина скачка титрования в окислительно-восстановительном титровании зависит от разности стандартных (формальных) потенциалов окислителя и восстановителя. Все факторы, влияющие на величину этих потенциалов, оказывают влияние и на величину скачка титрования. Если в реакции, протекающей при титровании, принимают участие протоны, то ход кривой титрования зависит от рН. В отличие от других видов титрования внешний вид кривой окислительного титрования практически не зависит от концентрации титруемого вещества и титранта, если только при титровании не изменяется число частиц, как при титровании дихроматом, а также если раствор не разбавлен настолько, что протекающую реакцию уже нельзя считать количественной.
