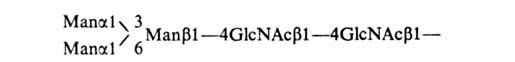Структурно-адгезивные гликопротеины
ФИБРОНЕКТИН – димер из двух полипептидных цепей, связанных между собой дисульфидными мостиками, содержит 4-5% углеводов. Различают:
растворимый Фибронектин плазмы
нерастворимый Фибронектин тканей.
Отличаются эти две разновидности по степени гликозилирования.
Р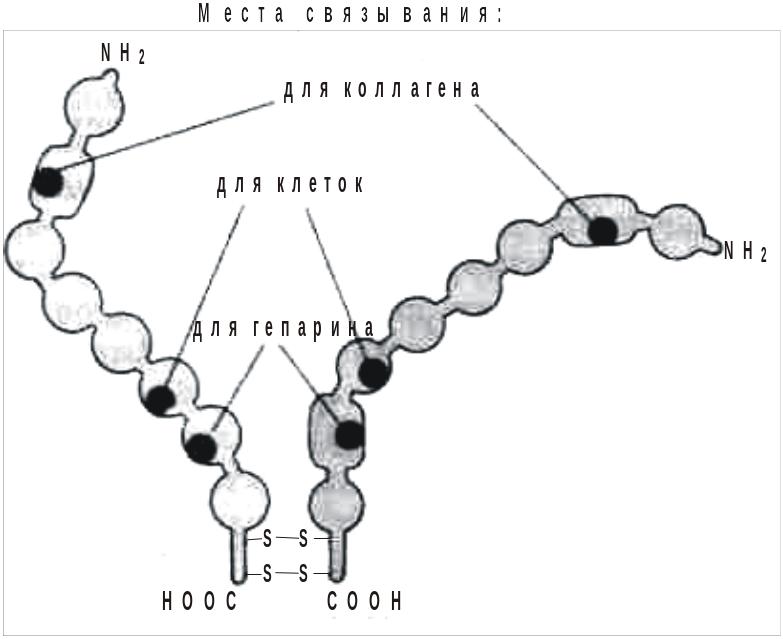 ис.
Димер фибронектина (Альбертс Б., 1994). Две
полипептидные цепи сходны, но не
идентичны, вблизи карбоксильного конца
соединены двумя дисульфидными связями.
Каждая цепь свернута в ряд глобулярных
доменов,
соединенных гибкими полипептидными
сегментами. Отдельные домены предназначены
для связывания с той или иной молекулой
или клеткой (указано для 3 доменов).
ис.
Димер фибронектина (Альбертс Б., 1994). Две
полипептидные цепи сходны, но не
идентичны, вблизи карбоксильного конца
соединены двумя дисульфидными связями.
Каждая цепь свернута в ряд глобулярных
доменов,
соединенных гибкими полипептидными
сегментами. Отдельные домены предназначены
для связывания с той или иной молекулой
или клеткой (указано для 3 доменов).
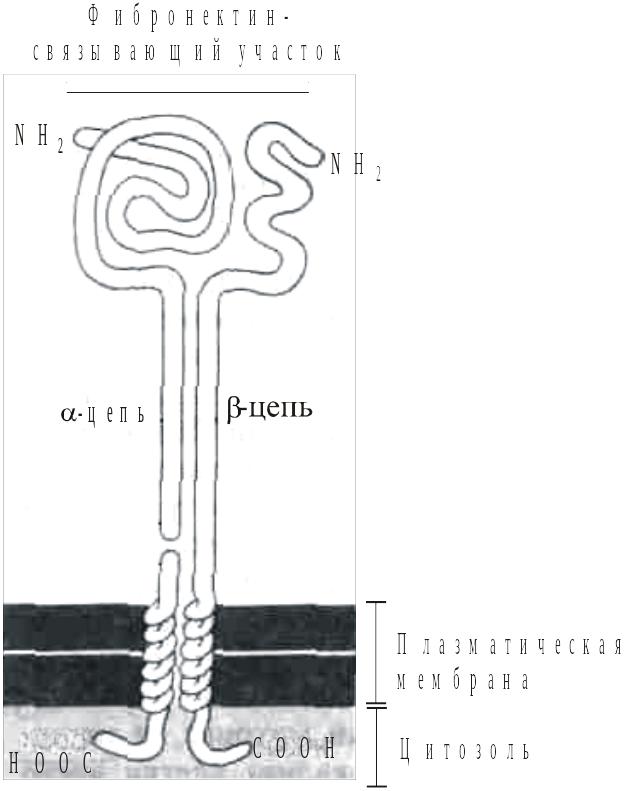 Рис.
рецептор
фибронектина
Рис.
рецептор
фибронектина
Синтез: Тканевой фибронектин синтезируется в фибробластах, макрофагах. Большое количество образуется в эмбриональных и развивающихся тканях.
Фибронектин присутствует на поверхности многих клеток, в том числе:
соединительной ткани и базальной мембраны сосудов,
в плаценте,
в синусоидах печени,
строме лимфоидной и легочной ткани,
в почках,
вокруг клеток мышц (гладкомышечных и поперечно-полосатых)
Он способствует прикреплению клеток к субстрату, их миграции, поддерживает их нормальные морфологию и поведение.
Для циркулирующего в крови Фибронектина источники синтеза – нейтрофилы, макрофаги, тромбоциты и фибробласты, сосудистый эндотелий, гломерулярные клетки почек. Из плазмы Фибронектин способен переходить в ткани.
Функции
1). Регулятор мезенхимально-эпителиального взаимодействия в ходе морфогенеза.
2). Контролирует расположение мезенхимальных клеток вдоль базальной мембраны.
3). Необходим для формирования зачатков зубов.
4). Контролирует рост коллагеновых волокон, взаимодействуя с коллагеном.
5). Находясь в составе межклеточного вещества в мышцах, образует связи с актином (это один из способов выполнения опорной функции соединительной тканью).
6). Обладает адгезивными свойствами. На поверхности Фибробластов образует прочные перекрестные связи с сульфатированными гликозаминогликанами.
7). Плазменный Фибронектин включается в состав кровяного сгустка, т.к. образует прочные связи с фибрином, фибриногеном, гепарином.
8). функции опсонина: склеивая все Грам-положительные и большую часть Грам-отрицательных бактерий, облегчает фагоцитоз. Регулирует активность макрофагов.
9). Фибронектин взаимодействует с компонентами комплемента, способствуя проявлению их защитных свойств.
10). Деградация Фибронектина – одно из звеньев воспалительной реакции.
Норма. В плазме концентрация Фибронектина в среднем 300 мг/л (у женщин 240-290 мг/л, у мужчин 200-320 мг/л). У детей (до года) около 200, затем постепенно возрастает примерно в 1,5 раза.
В сыворотке концентрация Фибронектина на 35-40% ниже, чем в плазме, т.к. он участвует в тромбообразовании.
Резко снижается концентрация Фибронектина при ожоговой болезни, септическом шоке. Снижение более чем на 50% - прогностически неблагоприятный признак. Снижение его количества при ожоговой болезни, радиационном поражении объясняется тем, что в некротических тканях освобождается много олигонулеотидов. Фибронектины связывают олигонуклеотиды, чрезмерно расходуются и фибронектинов становится недостаточно. Этим объясняется осложнение болезней инфекциями. У часто болеющих детей концентрация Фибронектина снижена, поэтому они подвержены инфекционным заболеваниям.
Повышается концентрация Фибронектина при ревматическом артрите, гломерулонефрите, системных заболеваниях, воспалении, в атеросклеротических бляшках.
Кроме опсониновой функции Фибронектин обладает хемотаксическими свойствами, благодаря чему в области воспаления скапливаются Фибробласты. Фибронектин усиливает фагоцитоз не только за счет связывания частиц, но и через активацию самого процесса фагоцитоза. При взаимодействии с моноцитами и нейтрофилами Фибронектин усиливает экспрессию С3b и Fc-рецепторов, которые облегчают фагоцитоз связанных с IgG и опсонизированных частиц и тем самым стимулируют фагоцитарную активность этих клеток. Фибронектин усиливает продукцию активных метаболитов кислорода в механизме респираторного взрыва при контакте фагоцитов с антителами или иммунными комплексами.
Увеличение концентрации Фибронектина в крови происходит при воспалении. Но при этом он активно потребляется клетками РЭС и поврежденными тканями. В результате развивается его дефицит, особенно при тяжелых инфекционных заболеваниях, при сепсисе, после хирургических вмешательств, при ожогах, травмах, при истощении в результате голодания.
Концентраты Фибронектина используют в лечении тяжелых больных с ожогами и травмами. Однако этот препарат достаточно дорогой и не всегда доступен.
ЛАМИНИН – обязательный гликопротеин всех базальных мембран, адгезивный белок для эпителиальных и мезенхимальных клеток. Молекула имеет крестообразную форму с тремя одноцепочечными и одной трехцепочечной ветвью. Ламинин локализован соответственно распространению коллагена IV-го типа. Взаимодействует с коллагеном IV, нидогеном, фибронектином, клетками. Ламинин содержит большое количество цистеина, оксипролин и оксилизин отсутствуют, содержит последовательность RGD. Основная функция – обеспечение адгезии (прилипания) клеток вдоль базальных мембран, способность связывать клетки и модулировать клеточное поведение: рост, дифференцировку и подвижность клеток.
Нидоген – сульфатированный гликопротеин базальных мембран, связывается с ламинином и коллагеном IV. Содержит последовательность RGD, поэтому и может присоединяться к клеточной поверхности
Антиадгезивные белки
Остеонектин – (син SPARC) кислый белок богатый цистеином. Состоит из 4 доменов, к двум может присоединяться кальций. Ингибирует G1-S-фазу роста эндотелиальных клеток.
Тромбоспондин – в клетках роговицы глаза и тромбоцитах проявляет адгезивные свойства, а в клетках эндотелия и фибробластах функционирует как антиадгезивный белок.
ГЛИКОПРОТЕИНЫ – соединения, в молекулах которых остатки олиго- или полисахаридов связаны с полипептидными цепями белка ковалентно (О- или N-гликозидными связями). Гликопротеины широко распространены не только в соединительной ткани, но и в природе в целом. К ним относят компоненты плазмы крови (иммуноглобулины, трансферрины ...), вещества, определяющие группу крови, некоторые гормоны, лектины, ферменты, антигены многих вирусов (гриппа, кори, энцефалита ...).
О-гликозидная углевод-белковая связь гликопротеинов образуется с участием ОН-группы гидроксиаминокислот.
гидроксилизин – в комбинации с галактозой (Gal)
гидроксипролин – в комбинации с галактозой (или арабинозой)
В отличие от обычных белков полипептидные цепи О-гликозилпротеинов, сильно обогащены остатками серина и треонина, которые чаще всего находятся в узле углевод-белковой связи. К серину могут присоединяться N-ацетилглюкозамин (GlcNAc), манноза (Man) и галактоза, к треонину – фукоза (Fuс), однако подавляющее большинство таких гликопротеинов содержит в узле углевод-белковой связи один и тот же дисахаридный фрагмент из остатков галактозы и N-ацетилгалактозамина (GalNAc) – имеет строение Galβ1–3GalNAcα1 (цифры обозначают номера атомов С в моносахаридах, а греч. буквы – конфигурацию аномерного атома С) (его называют «кор» или стержень). Кор связан с атомом О гидроксильной группы остатка серина или треонина (см. рисунок). За кором в составе углеводных цепей таких гликопротеинов могут следовать остатки N-ацетилглюкозамина, L-фукозы и(или) N-ацетилнейраминовой к-ты (NeuAc).
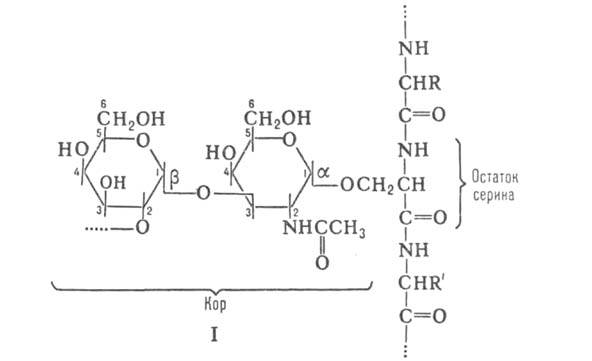
N-гликозидная углевод-белковая связь образуется с участием N-амидной группы аспарагина в полипептидной цепи, т.е. N-гликозилпротеины связаны гликозил-амидными связями. В гликопротеинах с атомом N амидной группы аспарагина соединен N-ацетилглюкозамин. В этом случае кор углеводной цепи гликопротеинов – пентасахарид: