
Соединительная ткань (лекция доц. Жаворонок т.В., сокращенный вариант для студентов)
Соединительная ткань преобладает в организме и очень важна. Среди её функций
главные функции: 1) защитная (противоинфекционная защита, ограничение тканевых повреждений, репарация) 2) опорно-структурная.
Задача настоящей лекции обсудить опорно-поддерживающую функцию соединительной ткани и биохимические механизмы, участвующие в её выполнении.
Соединительная ткань распределена по всему телу. В частности:
1) входит в состав хрящей, сухожилий, связок,
2) входит в состав матрикса костей
3) составляет основу межклеточного связывающего вещества в паренхиматозных органах (печень и др.) и в мышцах
4) "подстилает" кожу
5) служит для фиксации кровеносных сосудов
6) находится в области почечной лоханки, мочеточников
7) составляет основу рубцовой ткани.
В состав соединительной ткани входят:
клеточные элементы (клетки фибробластического ряда, тучные клетки, Т- и В-лимфоциты, макрофаги, нейтрофилы (полиморфноядерные лейкоциты=ПМЯЛ),
внеклеточный матрикс (основная часть соединительной ткани).
Клетки соединительной ткани функционируют в тесном взаимодействии. У каждого вида клеток свои собственные задачи. В связи с этим их условно делят:
1. "производственные" (клетки Фибробластического ряда) синтезируют и выделяют вещества внеклеточного матрикса;
2. регуляторные (тучные клетки, ПМЯЛ, макрофаги, лимфоциты).
Работу регуляторных клеток схематично можно представить следующим образом:
тучные клетки выделяют биологически активные соединения (гистамин, серотонин, другие медиаторы), которые влияют на микроциркуляцию. При этом изменяется в ту или другую сторону просвет мелких сосудов (артериол и капилляров), а также проницаемость их стенок для других клеток - лимфоцитов, макрофагов, ПМЯЛ. Тучные клетки оказывают активирующее влияние на Т-лимфоциты и макрофаги.
Т-лимфоциты и макрофаги в свою очередь взаимно влияют друг на друга. В результате оба этих вида клеток, каждый по-своему, активируют фибробласты, в которых запускается синтез коллагена, эластина и других компонентов внеклеточного матрикса.
ПМЯЛ убирают все лишнее, приводят в порядок результаты работы других клеток. Они работают в комплексе с макрофагами.
Внеклеточный матрикс обеспечивает механическую и поддерживающую функции соединительной ткани.
В состав внеклеточного матрикса входят:
Фибриллярные белки (Коллаген, Эластин)
Структурные гликопротеины (Фибронектин, Ламинин).
Протеогликаны 3 класса (в их составе 6 классов гликозаминогликанов, присоединенных к сердцевинным (кóровым) белкам).
Фибриллярные белки.
КОЛЛАГЕН – самый распространенный белок организма человека. Он составляет около 6 % массы тела. Характерное свойство коллагена – нерастворимость в воде. Лишь при долгом кипячении возможна желатинизация коллагена.
Коллаген образует нити (фибриллы) различной толщины. Расположение нитей коллагена обеспечивает выполнение их функции. А главная функция коллагена – придавать тканям прочность на разрыв.
Коллагеновые волокна (нити) образованы молекулами тропоколлагена. Тропоколлаген состоит из 3-х субъединиц. Каждая субъединица содержит ≈ 1000 аминокислотных остатков, закрученных в плотную левую спираль, на один виток спирали приходится 3 аминокислотных остатка.
Три спирали вместе образуют структуру, похожую на кабель, слегка закрученную в правую спираль – тропоколлаген.

Уникальная структура тропоколлагена обусловлена высоким содержанием глицина (1/3), иминокислот – пролина и оксипролина (1/4) и присутствием 5-оксилизина (1%).
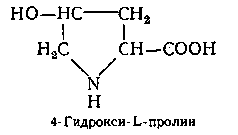

Главным образом, 4-гидрокси-L-пролин. Некоторые формы коллагена содержат также 3-гидрокси-L-пролин, хотя и в весьма ограниченном количестве:
Формула коллагена (ГЛИ-Х-У)n
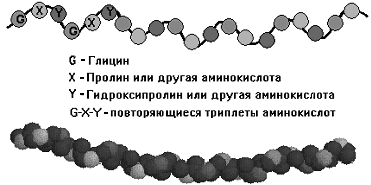
Пирролидоновые кольца иминокислот имеют особые стереохимические свойства, благодаря которым ограничивается гибкость полипептидной цепи и формируется вторичная структура в виде отдельных спиралей. Спирали очень компактны, т.к. каждая третья аминокислота в полипептидной последовательности – глицин. Глицин по размеру очень мал, поэтому легко помещается внутри коллагенового полимера, где никакая другая аминокислота не могла бы поместиться. Плотностью укладки обеспечивается суперспирализация: на один шаг спирали – 3 аминокислоты, а в других белках – 3,6.
Три субъединицы (α-цепи) в тропоколлагене стабилизируются в третичную структуру водородными связями между -С=О...NH- группами пептидных связей соседних цепей.
Четвертичная структура формируется при агрегации молекул тропоколлагена в фибриллы и стабилизируется поперечными сшивками (сшивки рассматриваем дальше). Молекулы в фибриллах коллагена соединены конец к концу и бок о бок. Параллельные цепи тропоколлагена в фибриллах уложены так, что начало молекул в соседних цепях смещено на четверть длины цепи. Такое расположение обеспечивает перекрывание, необходимое для взаимодействия N-концевого участка одной молекулы тропоколлагена с С-концевым участком другой молекулы. Такая ступенчатость придает коллагеновому волокну характерную поперечную исчерченность с интервалом 680 А. Биологическое значение смещения волокон связано с тем, что в промежутках вдоль ряда молекул тропоколлагена откладываются первые кристаллы гидроксиапатита при оссификации кости.
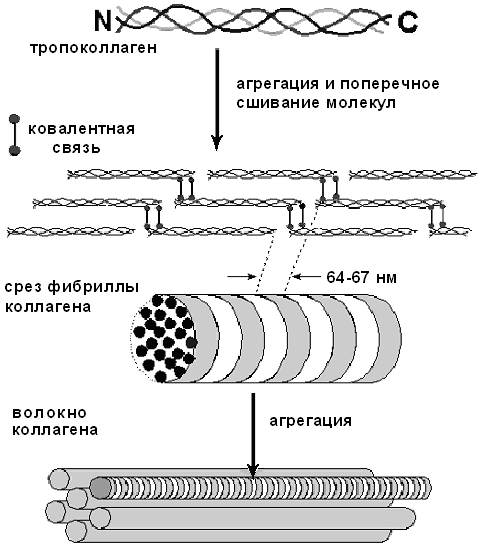
Рис. 9. Образование волокон при агрегации коллагеновых фибрилл
Типы коллагена. Цепи тропоколлагена немного отличаются друг от друга, поэтому различают цепи: альфа1, альфа2 и другие (свыше 25). В зависимости от того, из каких именно альфа-цепей состоит тропоколлаген, формируются генетически разные типы коллагена: I, II, III, IV и др. (около 20 типов изоколлагенов).
Каждый из них входит преимущественно в состав какой-то определенной ткани:
Тип I - в кости, дентине, сухожилиях, коже, роговице глаза;
Тип II - в хряще, межпозвонковых дисках, стекловидном теле глаза;
Тип III - в коже эмбриона, в сердечно-сосудистой системе и в патологически измененных тканях;
Тип IV - в базальных мембранах.
Распределение коллагена (подробнее)
коллаген I кожа, сухожилия, кости, дентин, плацента, артерии, печень, роговица
коллаген II хрящи, межпозвоночные диски, стекловидное тело, роговица
коллаген III артерии, матка, кожа плода, строма паренхиматозных органов
коллаген IV базальные мембраны
коллаген V при коллагене 1 и 2
коллаген VI хрящи, кровеносные сосуды, связки, кожа. матка, легкие почки
коллаген VII амнион, кожа, пищевод, роговица
коллаген VIII роговица, кровеносные сосуды, эндотелий
коллаген IX при коллагене 2
коллаген X хрящи гипертрофированные
коллаген XI при коллагене 2
коллаген XII при коллагене 1
коллаген XIII многие ткани
коллаген XIV при коллагене 1
коллаген XV многие ткани
коллаген XVI многие ткани
коллаген XVII гемидесмосомы кожи
коллаген XVIII многие ткани, печень, почки
коллаген XIX клетки рабдомиосаркомы
В зависимости от особенностей строения и общности функций разные коллагены делят на 3 основные группы:
Изоколлагены типов I, II, III, V, XI – фибриллформирующие или фибриллярные.
Изоколлагены типов IX, XII, XV, XVI и XVIII – фибриллассоциируемые, потому что обычно связаны с коллагеновыми волокнами, которые уже образованы фибриллформирующими типами коллагенов. Фибриллассоциированные коллагены не теряют дополнительные пептиды после секреции и обеспечивают соединение фибриллформирующих волокон коллагена с другими молекулами матрикса.
Изоколлагены типов IV, VI, VII, VIII и X – сетьформирующие. Эти изоколлагены образуют сетевидные структуры и чаще всего находятся в базальных мембранах, обеспечивая связь клеточных слоёв эпителия с подлежащей соединительной тканью, что особенно важно для кожи. В коже фибриллы таких изоколлагенов образуют нерегулярно сплетённую и очень густую сеть – выделанная кожа представляет собой почти чистый коллаген.
