
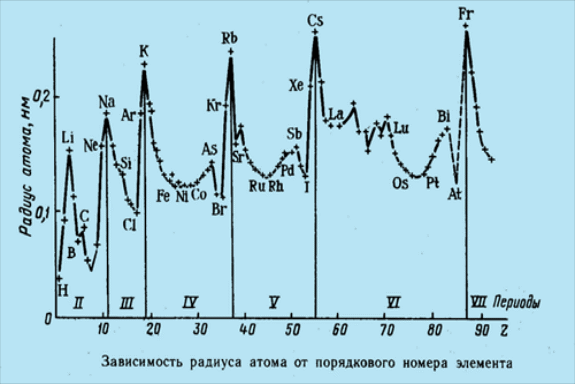
- •Химия как раздел естествознания и ее роль в современном обществе.
- •Строение атома
- •Экспериментальные доказательства сложности строения атома
- •Электрон
- •Радиоактивность и строение ядер атома
- •Радиоактивные и стабильные изотопы Изотопы.
- •Модели строения атома. Планетарная модель атома
- •Строение атома водорода по Бору
Модели строения атома. Планетарная модель атома
Нейтральность атома при наличии в нем электронов приводила к выводу о существовании в атоме области, несущей положительный заряд. Распределение положительного и отрицательного зарядов в атоме выяснилось в 1911 г в результате опытов Э.Резерфорда по рассеянию -частиц (He2+).
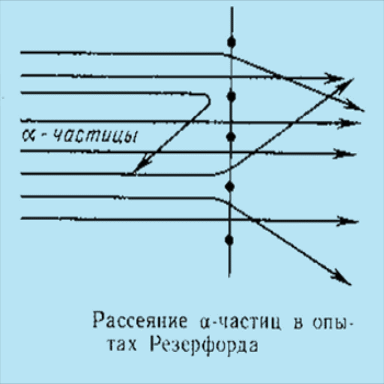
В этих экспериментах Э. Резерфорду и его ученикам удалось определить заряд ядра некоторых элементов. Было показано, что заряд ядра, выраженный числом элементарных зарядов, равен порядковому номеру элемента в периодической системе.
Изучая рассеяние -частиц, проходящих сквозь тонкие металлические пластинки , Резерфорд пришел к выводу, что весь положительный заряд и основная масса атома сосредоточены в центральной, очень малой по объему части атома - в ядре .
Оказалось, что диаметр ядра порядка 10-5 нм, а диаметр атома 10-1 нм, т.е. объем ядра в 10 4 раз меньше объема атома.
вишня
Для объяснения строения атома была предложена , согласно которой электроны движутся вокруг ядра подобно планетам вокруг Солнца.
Наиболее просто устроен атом водорода. Он состоит из положительно заряженного ядра, названного протоном, и одного электрона, движущегося вокруг ядра.
При этом было постулировано:
В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3. Вокруг ядра по замкнутым орбитам вращаются электроны. Их число равно положительному заряду ядра.
Развитая Резерфордом модель была крупным шагом вперед в познании строения атома . Она была подтверждена большим числом экспериментов. Однако, в некоторых отношениях модель противоречила твердо установленным фактам. Отметим два таких противоречия.
Во-первых, теория Резерфорда не могла объяснить устойчивости атома. По законам классической электродинамики электрон, двигаясь вокруг ядра, неизбежно теряет энергию. С уменьшением запаса энергии у электрона радиус орбиты его вращения должен непрерывно уменьшаться и в результате электрон должен упасть на ядро и прекратить свое существование. Фактически же атом представляет собой устойчивую систему и может существовать, не разрушаясь, чрезвычайно долго.
Во-вторых, модель Резерфорда приводила к неправильным выводам о характере атомных спектров. Линейчатость реальных атомных спектров противоречила законам классической электродинамики, согласно которой спектр атомов должен быть непрерывным в результате непрерывного излучения электроном энергии .
Строение атома водорода по Бору
получают, пропуская излучение возбужденных атомов (в пламени с высокой температурой или другими способами)через специальное оптическое устройство (призму или систему призм), которое разлагает сложное излучение на монохроматические составляющие с определенной длиной волны и, соответственно, с определенной частотой колебания электромагнитного излучения =с/, где c - скорость света. Каждый монохромный луч регистрируется в определенном месте принимающего устройства. В результате получается спектр данного излучения. Атомные спектры состоят из отдельных линий - это .
Из рисунка убрать подпись

линейчатый спектр водорода
Каждый вид атомов характеризуется строго определенным расположением линий в спектре, не повторяющихся у других видов атомов. Ко времени появления планетарной модели были изучены спектры многих атомов. Особенно тщательно был исследован атомный спектр водорода. Для него эмпирически была найдена формула Ридберга, которая позволяла вычислить длину волны , соответствующую любой линии в спектре :
1/=R (1/n12-1/n22)
где R- константа Ридберга, n1,n2 - переменные величины, которые могут принимать лишь определенные целочисленные значения, что и обуславливает дискретность значений , т.е. линейчатость атомных спектров. Однако физический смысл R,n1,n2, а следовательно, причина линейчатости атомных спектров были неясны.
Устойчивость атомов и природу атомных спектров объяснил в 1913 году датский физик Бор.
Основные положения своей теории Бор сформулировал в виде двух постулатов, содержание которых сводится к следующему :
Электрон может вращаться вокруг ядра не по любым, а только по определенным круговым орбитам . Эти орбиты получили название стационарных . Каждая орбита характеризуется радиусом rn и энергией En , где n-номер орбиты.
Двигаясь по стационарной орбите , электрон не излучает энергию.
Излучение или поглощение происходит при переходе электрона с одной стационарной орбиты
Убрать из подписи рис10 и попробовать сделать синим
на другую .
h=E=Eкон.-Eнач. (2)
где Eнач. , Eкон. - энергия конечного и начального состояния электрона.
Математически условие стационарности орбиты представляется формулами :
mevern=nh/2 .
meve2/rn=e2/rn2
где me,ve,e- масса , скорость и заряд электрона, - h постоянная Планка .
Первая формула представляет собой условие квантования стационарной орбиты. Вторая - условие равновесия сил , действующих на систему электрон - ядро.
Из формулы
meve2/rn=e2/rn2
можно определить радиус стационарной орбиты :
rn=n2h2/42mee2
Так , для радиуса первой орбиты электрона в атоме водорода
r1=0,0529 нм ,
для других стационарных орбит
rn=0,0529n2.
Знание радиусов стационарных орбит rn позволило Н.Бору найти энергию электрона на каждой из них.
Энергия любого движущегося тела складывается из его кинетической и потенциальной энергии. Кинетическая энергия электрона массы m, движущегося со скоростью v, равна mv2/2. Потенциальная энергия электрона, находящегося на расстоянии r от ядра с зарядом +e, будет - e2/r Потенциальная энергия электрона в атоме всегда отрицательна , поскольку при сближении электрона с ядром энергия выделяется , т.е. потенциальная энергия не связанного с ядром электрона выше, чем связанного . Потенциальная энергия электрона , не связанного с ядром , условно принимается равной нулю.
Полная энергия электрона E равна сумме его кинетической энергии и потенциальной :
E=mv2/2-e2/r
Подстановка значений mv2 и r приводит к выражению:
E=-me422/h2n2
В формуле n единственная переменная величина. Так как n принимает целочисленные значения (1,2,3,4 ...), то энергия электрона может принимать только определенные значения , т.е. в соответствии с теорией Бора энергия электрона , как и радиус его возможных орбит, изменяется определенными порциями - квантуется .
Минимальная энергия E1 отвечает минимальному значению n, равному 1 , и вращению электрона по первой стационарной орбите с радиусом r1=0,0529нм :
E1=-13,6 эВ
Каждое следующее возможное значение энергии можно получить, умножив E1 на 1/n2 .
Первый рис оставить, а второй более крупный убрать
Из рисунка убрать подпись


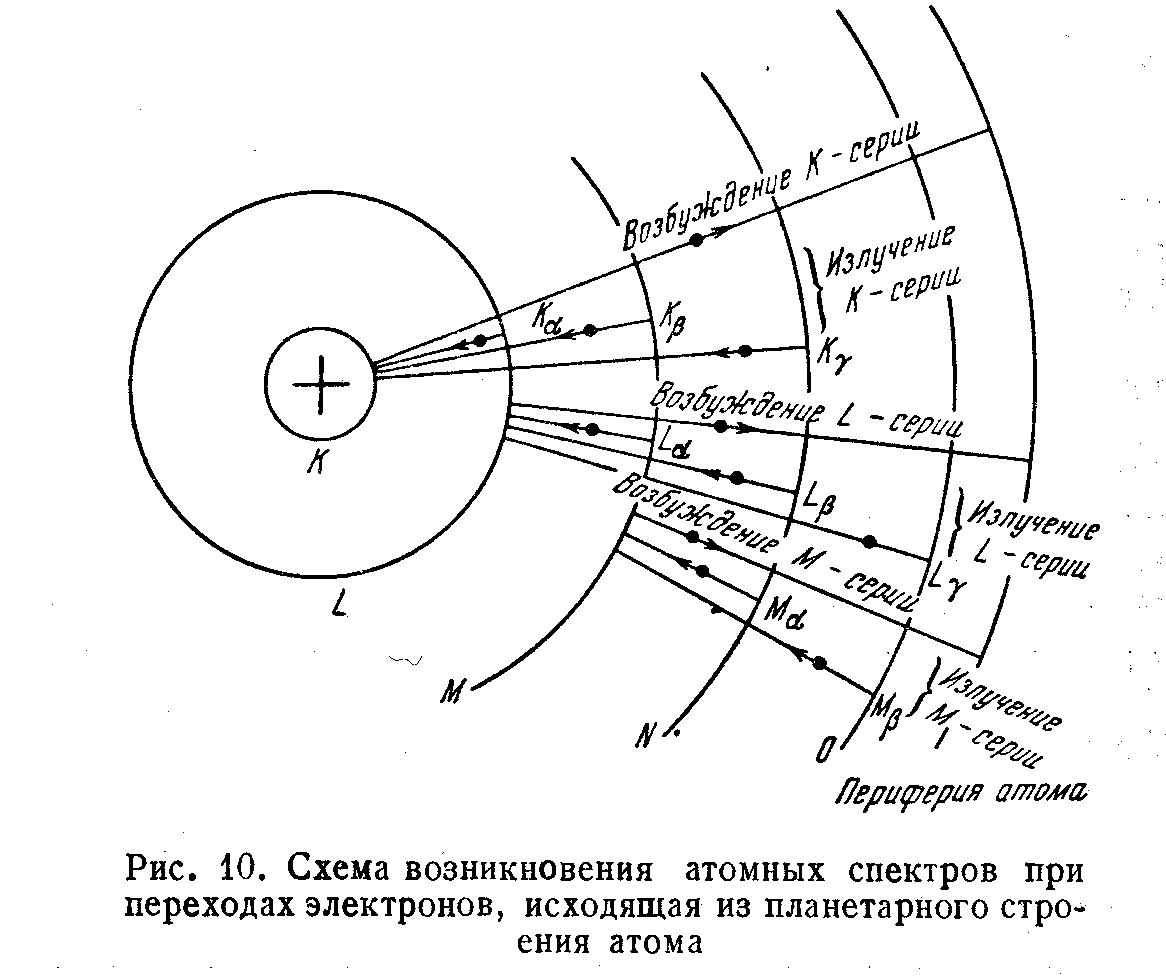
Возникновение атомного спектра по теории Бора таково. В атомах , не подвергшихся достаточно сильному внешнему воздействию, электрон движется по ближайшей к ядру стационарной орбите, т.е. обладает минимальной энергией E1. Это соответствует самому устойчивому, основному состоянию атома. Если подвергнуть атомы воздействию внешнего источника энергии, т.е. направить на них поток энергии , то электрон может поглотить один квант энергии. При этом новая энергия электрона E2 станет больше, чем его энергия в основном состоянии, на энергию поглощенного кванта:
E2=E1+h
Атом , энергия которого больше, чем энергия в основном состоянии, называется возбужденным атомом. Электрон в возбужденном состоянии движется по более удаленной от ядра орбите . Возбужденное состояние - неустойчивое состояние. Через короткое время электрон возвращается в исходное состояние, выделяя квант энергии h. Значение кванта энергии h (частота колебаний кванта) определяется разностью энергии электрона в возбужденном атоме E2 и не возбужденном E1 :
h=E2-E1
Подставляя значения E1 и E2, Н.Бор пришел к эмпирической формуле :
1/=22me4(1/n12-1/n22)/h3c
Эмпирическая формула получила теоретическое обоснование. Выяснился и смысл постоянной Ридберга R и переменных n1, n2.
Однако теория Бора подверглась существенной критике.
Во-первых, она не давала возможности рассчитать точно энергию многоэлектронных атомов, молекулярного иона водорода H2+.
Во-вторых, появились экспериментальные факты, которые не могли быть объяснены в рамках этой теории.
По мере развития техники было показано, что экспериментальные спектральные линии имеют тонкую структуру, т.е. состоят из нескольких линий, а при помещении излучающего атома в магнитное или электрическое поле на более тонкие, близко расположенные линии.

Стало очевидным, что теория Бора построена на ошибочном представлении о природе электрона. Н.Бор исходил из того постулата, что электрон - это материальная частица, факты, обнаруженные в XX столетии, показали, что электрон обладает двойственной природой – одновременно проявляет свойства и частицы, и волны.
Теория, в основе которой лежит представление о корпускулярно-волновой природе микрочастиц, называется квантовой механикой .
Волкову продолжить с этого места
Квантовая механика.
В 1889 г. А.Г.Столетов открыл и исследовал явление, получившее название . Это явление заключается в том, что под действием света из атомов вылетают электроны. Объяснить явление фотоэффекта оказалось возможным, только приняв положение о том, что свет является потоком частиц - фотонов. Исходя из этого положения, удобно рассматривать явление испускания и поглощения света.
Экспериментально известны волновые свойства света: - наложение световых волн и - рассеяние световых лучей, проходящих через дифракционную решетку. С другой стороны, квантовая теория излучения Планка хорошо сочетается с представлением о свете как о потоке частиц, каждая из которых является носителем определенной минимальной для данного вида излучения порции энергии - кванта энергии. Таким образом, свет проявляет свойства частиц (фотоэффект) и свойства волн (интерференция, дифракция) , т. е. обладает двойственной природой.
Корпускулярно-волновая природа света подчеркивается связью, которая существует между длиной волны и массой светового фотона m. Эта связь выражается формулой .
=h/mc
Формула просто выводится из уравнения Эйнштейна
E=mc2
и уравнения Планка
E=h .
Французский ученый Луи де Бройль(1924г.) высказал гипотезу, что двойственной природой обладает не только свет, но и любой материальный объект. Он постулировал формулу
=h/mv
где h - постоянная Планка , m - масса частицы , - скорость движения частицы , - длина волны де Броля.
Для проверки гипотезы Луи де Броля о наличии волновых свойств у любых материальных объектов были поставлены эксперименты по выяснению способности пучка электронов к дифракции. В 1927 г. ученые обнаружили . Таким образом, опыт подтвердил наличие волновых свойств у электрона. Позднее способность к дифракции была обнаружена у других микрообъектов и тем самым доказана двойственность свойств любых микрочастиц.
В 30-х годах ХХв сложилась наука, справедливая для любых материальных объектов, в том числе и для микрообъектов - квантовая механика.
Соотношение неопределенностей
Одним из основных положений квантовой механики является соотношение неопределенностей , установленное Гейзенбергом. Согласно этому соотношению невозможно одновременно точно определить местоположение частицы и ее импульс
p=mv .
Чем точнее определяется координата частицы x, тем более неопределенным становиться ее импульс p, и наоборот.
Соотношение неопределенностей имеет вид :
xph
или
xvh/m
где x- неопределенность в положении частицы (в значении ее координаты x), и p, v- неопределенности в величинах , составляющих импульса и скорости в направлении координаты x .
Аналогичные соотношения записываются и для координат y и z .
Уравнение Шредингера
Законы движения микрочастиц в квантовой механике выражаются уравнением Шредингера. Уравнение Шредингера является дифференциальным уравнением в частных производных. Для рассмотрения задач, встречающихся в теории атома и молекулы, это уравнение для одной частицы может быть записано в следующей форме:
-h2/82m (d2/dx2+d2/dy2+d2/dz2) + E = E
h - постоянная Планка, m-масса частицы, U- потенциальная энергия , Е - полная энергия, x,y,z - координаты. называется волновой функцией.
Входящая в уравнение величина называется волновой функцией. Ее квадрат 2 имеет вполне определенный физический смысл, характеризуя вероятность нахождения частицы в данном месте пространства. Величину 2 называют плотностью вероятности, или электронной плотностью. В соответствии с физическим смыслом волновой функции она должна быть конечной, непрерывной и однозначной, а также обращаться в нуль там, где частица не может находиться. Например, при рассмотрении движения электрона в атоме должна становиться равной нулю на бесконечно большом расстоянии от ядра.
Система понятий квантовой механики отличается от классической. Квантовая механика дает вероятность нахождения частиц и ничего не говорит о траектории движения частицы, ее координатах и скорости в тот или иной момент времени .
Квантово механическое решение задач в теории атома и молекулы сводится к нахождению функций , обладающих указанными свойствами, и значениями энергии E.
Квантово механическое строение атома водорода
Наиболее просто устроен атом водорода. Он состоит из положительно заряженного ядра, названного протоном, и одного электрона, движущийся в поле ядра.
В этом случае входящая в уравнение Шредингера функция потенциальной энергии U принимает вид
U=-e2/r.
Движение электрона удобно рассматривать в , центр которой совпадает с ядром атома. Если в прямоугольной системе координат положение частицы задается координатами x,y,z , то в полярной системе оно определяется величиной радиуса-вектора r и углами и . Полярные координаты связаны с прямоугольными следующими соотношениями :
x=r sin cos
y=r sin sin
z=r cos
Функция представляется в виде :
(r,,)=R(r)()()
где
R(r) - радиальная часть волновой функции ;
(),() - угловая часть.
Наличие трех степеней свободы приводит к тому , что в решении появляются три величины , которые могут принимать только целочисленные значения
три квантовых числа : n, l, ml .
Эти величины входят в выражение как радиальной , так и угловой составляющих .
В общем виде решение уравнения Шредингера для атома водорода можно выразить :
R(r)=1(n, l)
()=2(l, ml)
()=3(ml)
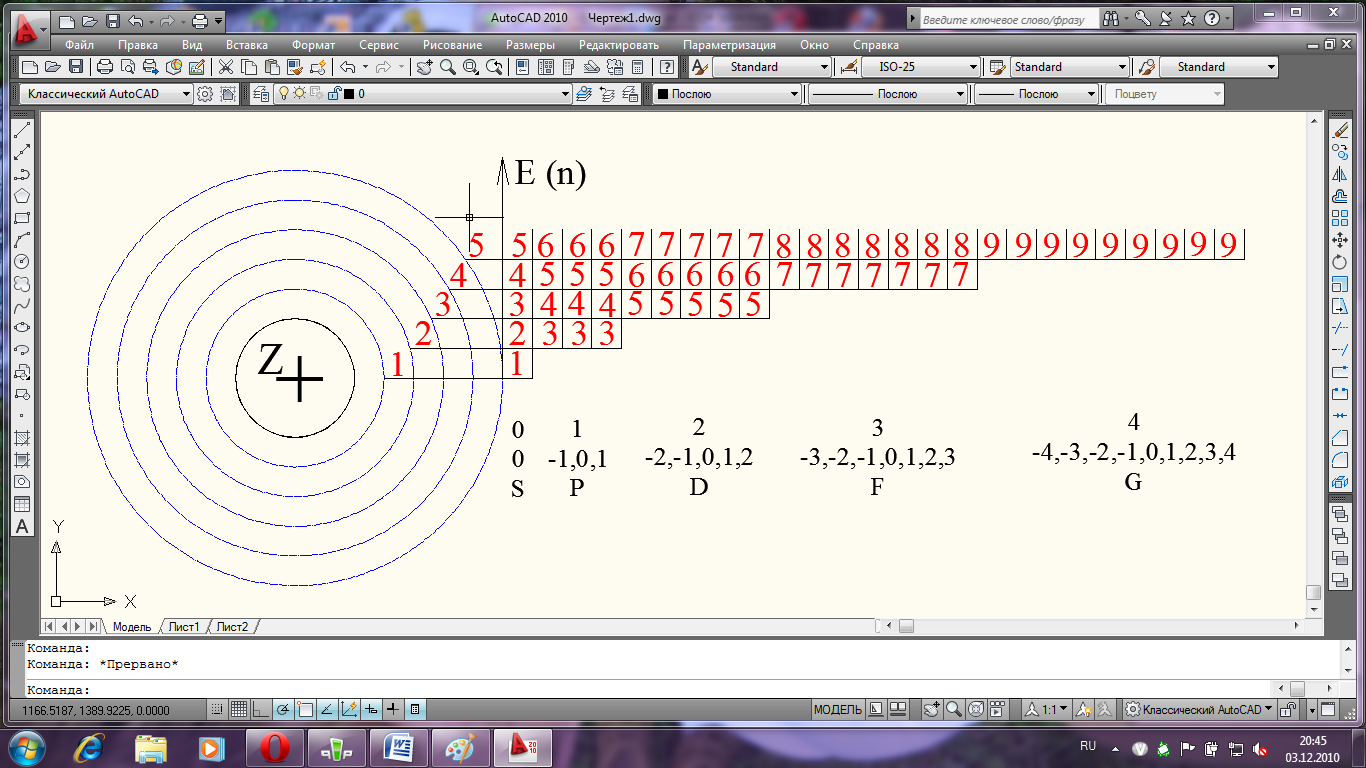
Квантовые числа n, l, ml могут принимать следующие значения :
n = 1, 2, 3, 4....
l = 0, 1, 2, 3 ... (n -1)
ml = 0, 1, 2 ... l
n и l входят в выражение функции R , поэтому они определяют функцию радиального распределения вероятности пребывания электрона в атоме .
Таким образом, согласно квантовой механике, электрон может находиться в любой точке атома , однако вероятность его пребывания в различных областях пространства неодинакова. Электрон чаще бывает в одних областях и реже в других областях атома. Поэтому, современным представлениям отвечает понятие об , плотность которого в различных точках определяется величиной 2. По этой причине вместо термина “ орбита “ квантовая механика использует понятие “орбиталь” , которое характеризует совокупность положений электрона в атоме . Каждой орбитали электрона соответствует определенная волновая функция . Для характеристики состояния электронов в атоме используются следующие обозначения :
величина квантового числа n обозначается цифрами
значение l - строчными буквами :
l ... 0 1 2 3 4 5
обозначение... s p d f g h
Тогда, запись 1s следует понимать как обозначение электрона , у которого n = 1 и l = 0 .
Запись 2p - как обозначение электрона , у которого n = 2 , l = 1 и т.д.
Число электронов в атоме с данными значениями n и l обозначается индексом сверху. Так , запись 2s2 показывает , что в атоме есть два электрона с n = 2, l = 0 .
В таблице приведены выражения волновых функций для некоторых состояний электрона в атоме водорода. Тригонометрические функции для сокращения записи определены через декартовы координаты и расстояние r .

Существуют различные способы графического представления волновых функций. Кривые для нескольких состояний электрона в атоме были представлены ранее. Форму электронного облака в значительной степени определяет угловая составляющая волновой функции () (). Для ее изображения пользуются полярными диаграммами . При их построении проводят из начала координат во все стороны отрезки , пропорциональные величинам () (). Концы отрезков образуют поверхность, показывающую .
Квантовые числа .
В квантовой механике каждая атомная орбиталь описывается тремя квантовыми числами : n, l, ml.
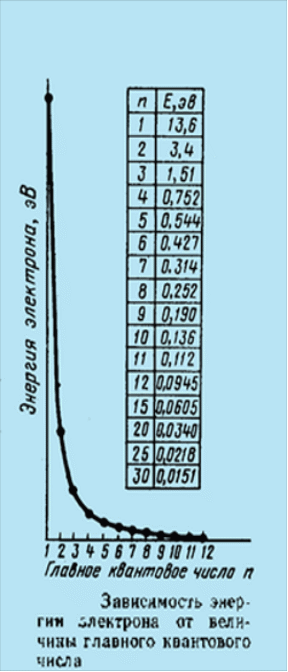
Главное квантовое число n аналогично по существу квантовому числу n в теории Бора. Оно определяет энергию электрона, находящегося на данном электронном уровне .
Главное квантовое
число может принимать любые целые числа
от 1 и далее. Ближайший к ядру уровень
характеризуется минимальной энергией,
и ему соответствует n = 1. При увеличении
n , увеличивается и энергия уровня .

Тонкая структура спектральных линий связывается с тем, что электроны, находящиеся на одном и том же уровне энергии, характеризующиеся одним и тем же значением главного квантового числа, все же несколько различаются между собой, т.е. уровень энергии с данным значением n состоит из нескольких подуровней (оболочек).
Электроны, занимающие разные подуровни данного уровня, отличаются величинами орбитального момента количества движения, равного
H (l (l+1) )1/2/2,
где l-орбитальное квантовое число. Оно может принимать любые целые значения от 0 до n -1 . Каждому значению l соответствует определенный подуровень энергии.
Если n = 1, т.е. имеется в виду первый электронный слой, то l может принимать только одно значение, равное 0. Следовательно, 1-й уровень энергии состоит из одного подуровня. Для n = 2 будут два значения l : 0 и 1. Значит 2-й уровень энергии содержит два подуровня. 3-й уровень (n = 3) включает три подуровня - значения l : 0, 1, 2 . Для удобства подуровни обозначают не цифрами, а буквами. Все подуровни, для которых l=0, обозначаются s , независимо от того, на каком уровне энергии они находятся. Цифра перед буквой означает главное квантовое число , или номер уровня. Например , 2s - подуровень - означает, что s-подуровень принадлежит 2-ому уровню энергии (n = 2). Подуровни , для которых l = 1 обознаются буквой p , l = 2 обознаются буквой d, l = 3 – обознаются буквой f .
В спектрах атомов, находящихся во внешнем магнитном или электрическом поле, обнаруживается расщепление спектральных линий на отдельные, более тонкие линии. Это свидетельствует о том, что подуровни также имеют сложную структуру, которая проявляется только при наложении магнитного поля.
Данное явление можно объяснить следующим образом: орбитальный момент количества движения - величина векторная .При наложении на систему внешнего магнитного поля этот вектор может совпадать с направлением поля, иметь противоположное направление или принимать промежуточное значение . Количество положений этого вектора, а, следовательно, и проекции его на ось, совпадающую с направлением магнитного поля , определяются значением магнитного квантового числа ml. Магнитное квантовое число ml может принимать любые целые значения от -l до +l , включая 0. Так, для подуровня s (l = 0) оно может иметь только одно значение ml = 0 . Это означает, что подуровень s состоит из одной атомной орбитали.
Для подуровня p (l = 1) ml может принимать три значения : -1, 0, +1 , т.е. подуровень p включает три атомные орбитали.
Подуровень d (l = 2) состоит из пяти атомных орбиталей. Подуровень f (l = 3) - состоит из семи атомных орбиталей. Полные структуры перовых четырех уровней представлены в таблице.
Волновые функции электрона в атоме водорода .
n |
l |
структура уровня |
ml |
1 |
0 |
1s |
0 |
2 |
0 1 |
2s 2p |
0 -1 0 +1 |
3 |
0 1 2 |
3s 3p 3d |
0 -1 0 +1 -2 -1 0 +1 +2 |
4 |
0 1 2 3 |
4s 4p 4d 4f |
0 -1 0 +1 -2 -1 0 +1 +2 -3 -2 -1 0 +1 +2 +3 |

В общем случае магнитное квантовое число ml характеризует в пространстве.
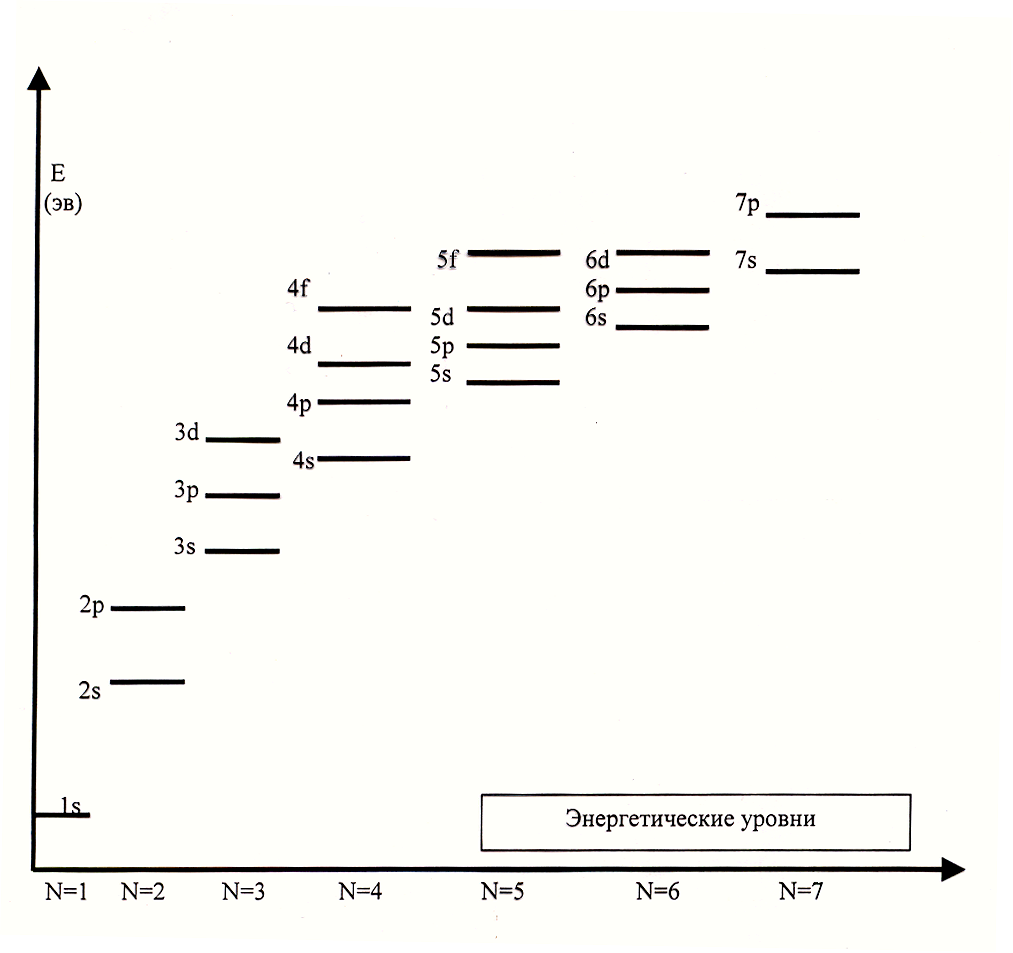
Структуру атомных электронных уровней можно изображать двояко :в виде электронных формул или в виде энергетических диаграмм и квантовых чисел .
При написании электронных формул используются два квантовых числа - n и l. Электронная формула 1-го электронного уровня - 1s , 2-го -2s, 2p , 3-го - 3s, 3p, 3d, 4-го - 4s, 4p, 4d, 4f и т.д.
Более полно строение электронных оболочек описывается с использованием трех квантовых чисел n , l и ml. Каждая атомная орбиталь условно изображается в виде квантовой ячейки - ячейки Гунда, около которой ставятся номер уровня и символ подуровня (например, 1s или 2s, 2р ). Подуровни каждого уровня смещены по высоте, так как энергия их различается. Стрелка в каждой ячейке означает электрон.
Энергетическая диаграмма в виде квантовой ячейки - первых шести уровней атома водорода представлена на рис.
Принцип минимальной энергии.
Распределение электронов по уровням и подуровням подчиняется принципу минимальной энергии. Согласно этому принципу, электроны располагаются на атомных орбиталях, имеющих мини-мальную энергию электрона.
Принцип запрета Паули
Принцип запрета Паули гласит: в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел, т.е. каждый электрон в атоме имеет свой набор квантовых чисел, который полностью определяет энергетическое состояние электрона.
Правило Хунда(Гунда):
Правило Хунда(Гунда) гласит: сумма спинов электронов, находящихся на одном подуровне, должна быть максимальна, знак суммы при этом не имеет значения. Следовательно, электроны на подуровне располагаются таким образом, чтобы имелось наибольшее возможное число параллельных спинов.
Электронные структуры многоэлектронных атомов
Энергетическую диаграмму в виде квантовой ячейки можно использовать как основу для описания электронного строения любого атома. Однако необходимо учесть, что в многоэлектронных атомах возникает сложное взаимодействие между ядром и электронами различных уровней, что приводит к перераспределению энергии подуровней.
При больших значениях n - энергии электрона подуровней сближаются , и иногда подуровни с большим значением n имеют меньшую энергию электрона, чем подуровень с меньшим значением n .
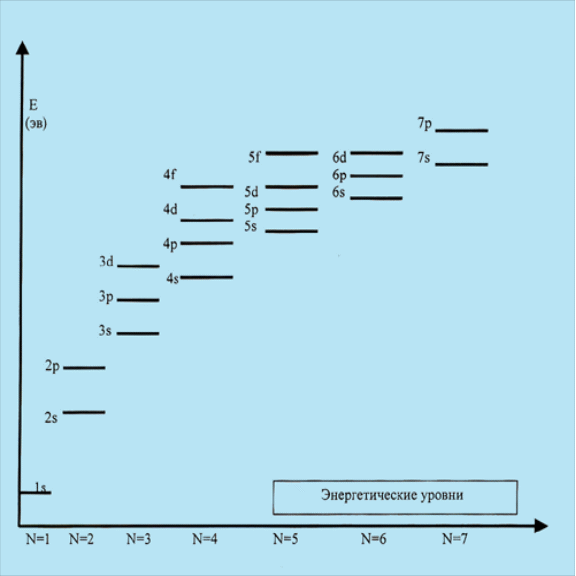
Порядок возрастания энергии атомных орбиталей в сложных многоэлектронных атомах описывается правилом Клечковского :
энергия орбиталей электрона возрастает в соответствии с увеличением суммы главного и орбитального квантовых чисел (n + l).
При одинаковом значении суммы чисел (n + l) энергия электрона меньше у орбитали с большим l и меньшим n , а у орбитали с меньшим n энергия электрона больше.
Так, например, орбиталь 3d имеет сумму n + l = 5, для орбитали 4p эта сумма равно 5. Сумма одинакова, но орбиталь 3d электрона имеет более низкую энергию , так как значение l у нее больше. Используя это правило , можно показать , что энергия орбиталей электрона возрастает следующим образом :
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f
Если для описания свойств электронов использовать только три квантовых числа - главное, орбитальное и магнитное, то электроны полностью идентичны. Эксперимент показал, что электроны различаются между собой. Индивидуальной характеристикой элекрона является спин, или внутренний

момент количества движения.
Спин нельзя выразить через классические координаты и импульсы, у него нет аналога в классической механике. Спин характеризуется спиновым квантовым числом s , которое может принимать два значения : +1/2 и -1/2
Четыре квантовых числа полностью характеризуют теоретическое состояние электрона в атоме. Для того, чтобы определить максимальное число электронов, которое может находиться на одной атомной обитали, используется принцип запрета Паули. Принцип запрета Паули гласит: в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел, т.е. каждый электрон в атоме имеет свой набор квантовых чисел, который полностью определяет энергетическое состояние электрона. Так, для атомной обитали 1s существует два набора квантовых чисел электронов:
n l ml s
1 0 0 +1/2
1 0 0 -1/2
Никаких других вариантов для s - орбитали любого уровня ( n= 1, 2, 3, ...) быть не может. Следовательно, на атомной s - орбитали может находиться 2 электрона, отличающихся спинами.
Для каждой их трех атомных орбиталей 2p также возможны только 2 набора квантовых чисел электрона:
n l ml s
2 1 1 +1/2
2 1 1 -1/2
Следовательно, на р -подуровне любого уровня может находиться 6 электронов.
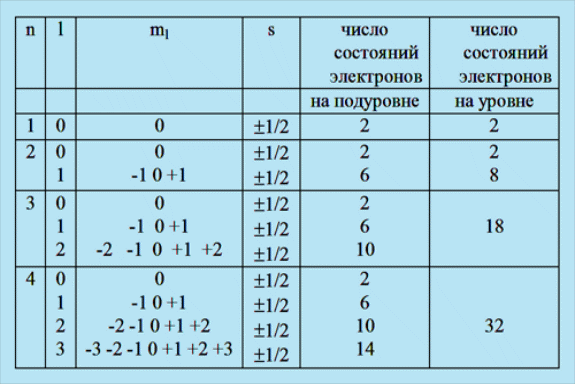
В таблице приводятся все возможные энергетические состояния электронов на первых четырех уровнях энергии.
-
n
l
ml
s
число состояний электронов
число состояний электронов
на подуровне
на уровне
1
0
0
1/2
2
2
2
0
1
0
-1 0 +1
1/2
1/2
2
6
2
8
3
0
1
2
0
-1 0 +1
-2 -1 0 +1 +2
1/2
1/2
1/2
2
6
10
18
4
0
1
2
3
0
-1 0 +1
-2 -1 0 +1 +2
-3 -2 -1 0 +1 +2 +3
1/2
1/2
1/2
1/2
2
6
10
14
32
-
n
l
ml
s
число состояний электронов
число состояний электронов
на подуровне
на уровне
1
0
0
±1/2
2
2
2
0
1
0
-1 0 +1
±1/2
±1/2
2
6
2
8
3
0
1
2
0
-1 0 +1
-2 -1 0 +1 +2
±1/2
±1/2
±1/2
2
6
10
18
4
0
1
2
3
0
-1 0 +1
-2 -1 0 +1 +2
-3 -2 -1 0 +1 +2 +3
±1/2
±1/2
±1/2
±1/2
2
6
10
14
32
Максимальное число электронов N на ypовне определяется формулой
N = 2n2 ,
где n - главное квантовое число.
Рассмотрим электронные структуры некоторых атомов.
Два элемента 1-ого периода относятся к s -элементам, так как в их атомах заполняется 1s-подуровень.
Атом водорода имеет один электрон. Этот электрон занимает атомную орбиталь с наименьшей энергией в соответствии с правилом Клечковского. Электронная формула, символизирующая структуру атома водорода
1s1,
где 1 - номер электронного уровня ; s - символ подуровня; верхний индекс - число электронов на s -подуровне ( s -орбитали).
Запишем электронную структуру атома водорода в виде.
Стрелка в каждой ячейке означает электрон.
Атом гелия имеет электронную формулу
1s2 .
Запишем электронную структуру атома гелия в виде . Стрелка в каждой ячейке означает спин электрона.
Элементы второго периода с точки зрения строения атома могут быть разбиты на две группы. Первые два элемента - Li и Bе , у которых заполняется s -подуровень, относятся к s - элементам, а остальные шесть - к р -элементам.
Все элементы 2-го периода будут иметь формулу электронных уровней 1s2s2p.
Для описания электронной структуры атома лития Li следует использовать 2-й уровень. Электронная формула имеет вид
1 s22 s1 .

Для атома бериллия Bе электронная формула имеет вид
1s22s2.


Для атома бора В начинается заполнение 2р – подуровня. Электронная формула имеет вид
1s22s22p1.
Единственный электрон 2р –под уровня можно поместить на любую из трех 2р -орбиталей. Запишем электронную структуру атома бора в виде . Стрелка в каждой ячейке означает спин электрона
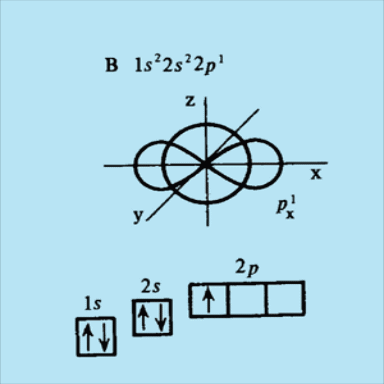
.
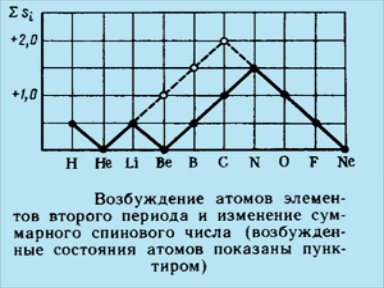

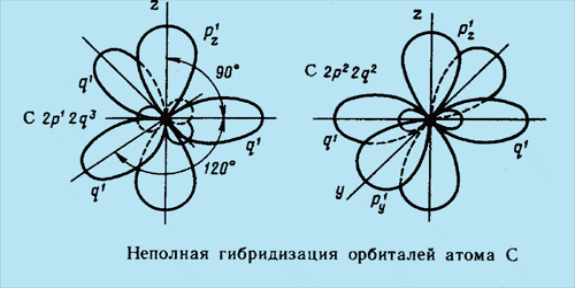
Для атома углерода С происходит заполнение 2р – подуровня. Электронная формула имеет вид
1s22s22p2
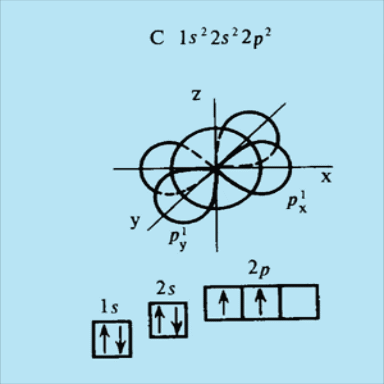
Для атома углерода С небезразлично, как разместить эти электроны - в одной квантовой ячейке 2р – подуровня или в разных.
Выбрать правильную
структуру из двух помогает правило
Хунда(Гунда): сумма спинов электронов,
находящихся на одном подуровне, должна
быть максимальна, знак суммы при этом
не имеет значения. Следовательно,
электроны на подуровне располагаются
таким образом, чтобы имелось наибольшее
возможное число параллельных спинов.
Запишем электронную структуру атома
углерода в виде .
Стрелка в каждой ячейке означает спин
электрона.
Для атома азота N происходит заполнение 2р – подуровня. Электронная формула имеет вид
1s22s22p3

Для атома азота N небезразлично, как разместить эти электроны - в одной квантовой ячейке 2р – подуровня или в разных.
Выбрать правильную структуру из двух помогает правило Хунда(Гунда): сумма спинов электронов, находящихся на одном подуровне, должна быть максимальна, знак суммы при этом не имеет значения. Следовательно, электроны на подуровне располагаются таким образом, чтобы имелось наибольшее возможное число параллельных спинов. Запишем электронную структуру азота N в виде . Стрелка в каждой ячейке означает спин электрона.
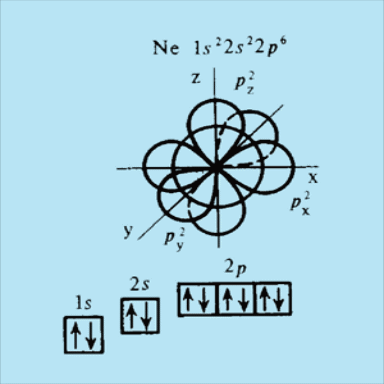
Заполнение 2p - подуровня заканчивается у Ne , который имеет шесть р - электронов
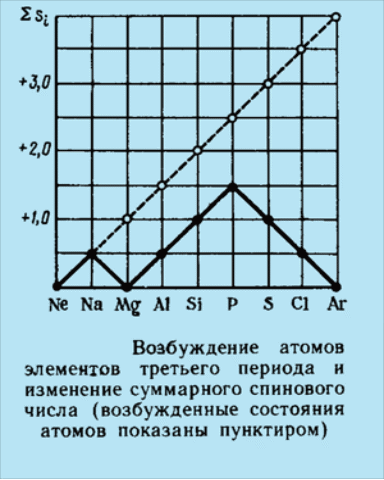
Электронные орбитали атомов элементов 3-го периода заполняются так же, как и электронные орбитали во 2-м периоде :имеются два s -элемента (Nа, Mg) и шесть р –элементов. Подуровень 3d у атомов элементов 3-го периода не заполняется, но он может быть использован при образовании гибридных атомных орбиталей.
Четвертый период - первый из больших периодов. Заполнение атомных орбиталей элементов больших периодов отличается от формирования электронных структур малых периодов. Число элементов четвертого периода равно 18. В четвертом периоде появляется третья группа из десяти элементов - это d -элементы.
Элементы четвертого периода с точки зрения строения атома могут быть разбиты на три группы. Первые два элемента - K и Сa, у которых заполняется s -подуровень, относятся к s – элементам. Элементы от Sс до Zn принимают электроны на 3d -подуровень ( d -элементы), а остальные шесть - к р -элементам.
Все элементы четвертого периода будут иметь формулу электронных уровней 1s2s2p3s3p3d4s4p4d4f. В соответствии с правилом Клечковского, энергия 3d -подуровня выше, чем подуровня 4s . Поэтому сначала используютсяя электронами 4s -состояние.
Для описания электронной структуры атома калия К следует использовать 4-й уровень. Электронная формула калия К имеет вид
1s22s22p63s23p64s1.
Для атома кальция Сa электронная формула имеет вид
1s22s22p63s23p64s2.
Элементы от Sс до Zn принимают электроны на 3d -подуровень ( d -элементы).
Для атома скандия Sc начинается заполнение 3d – подуровня. Электронная формула имеет вид
1e22s22p63s23p64s23d1.
Единственный электрон 3d –под уровня можно поместить на любую из пяти 3d -орбиталей. Запишем электронную структуру атома скандия Sc в виде . Стрелка в каждой ячейке означает спин электрона.
Таким образом, электронные формулы, для Sc и Мn, могут иметь следующий вид:
Sc 1e22s22p63s23p64s23d1
Мn 1s22s22p63s23p64s23d5
Однако установлено, что энергия электронов в атоме зависит не только от суммы главного и орбитального квантовых чисел, но и от величины заряда ядра. При увеличении порядкового номера происходит уменьшение энергии атомных орбиталей, причем особенно сильно это выражено у d- и f- элементов. Так, у d -элементов 3-го периода энергия 3d-уровня становится меньше энергии 4s. Поэтому истинные электронные формулы Sc и Мn следующие:
Sc 1s22s22p63s23p63d14s2
Mn 1s22s22p63s23p63d54s2
Последний из d -элементов – цинк Zn- имеет электронную формулу
1e22s22p63s23p63d104s2
Таким образом , у d- элементов в общем случае только два электрона находятся на внешнем электронном уровне(4s2).
Однако это правило нарушается - у хрома Cr и меди Cu имеется всго по одному 4s - электрону и соответственно структуры
Cr 1e22s22p63s23p63d54s1
Cu 1e22s22p6 3s23p63d104s1.
Связанно это с устойчивым состоянием электронных структур 3d5 и 3d10 и выигрышем энергии при их образовании.
После 3d- подуровня заполняется 4p-подуровень, по известным правилам.
Итак, элементы
4-ого периода представлены тремя
семействами : два элемента образуют
s-семейство , 10 элементов d-семейство
и 6 элементов - p-семейство .
Пятый период строится аналогично четвертому : два 5s-элементов , десять 4d -элементов, шесть 5p-элементов.
Шестой период содержит 32 элемента , которые составляют четыре группы. Два первых элемента -6s - элементы , La имеет структуру ... 5d16s2 , затем следуют четырнадцать 4f – элементов (от церия Се 4f15d15s2 до лютеция Lu - 4f145d16s2). После завершения 4f - подуровня идет заполнение 5d - подуровня, и последний 5d - элемент Hg имеет структуру 4f145d106s2, после чего заполняется 6p-подуровень.
Электронная стpуктуpa 7-го периода аналогична структуре 6-го периода, хотя 7-й период еще не закончен.
