
- •Химия как раздел естествознания и ее роль в современном обществе.
- •Строение атома
- •Экспериментальные доказательства сложности строения атома
- •Электрон
- •Радиоактивность и строение ядер атома
- •Радиоактивные и стабильные изотопы Изотопы.
- •Модели строения атома. Планетарная модель атома
- •Строение атома водорода по Бору
Строение атома
АТОМ КАК ИСХОДНЫЙ УРОВЕНЬ ХИМИЧЕСКОЙ ОРГАНИЗАЦИИ МАТЕРИИ
включает в себя понятия вещества и поля.
Низший уровень представлен своим набором элементарных частиц с массой покоя m≠0 и m=0 соответственно. Однако с точки зрения химической организации особо интересны только три типа элементарных частиц: .

При взаимодействии первых двух возникают положительно заряженные , которые притягивают отрицательно заряженные электроны, образуя . Атом – система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.
Ясно, что атом является неким уровнем в общей структуре материи, но с точки зрения химической организации он принимается как низший, исходный уровень.
Естественно, что схема, согласно которой атом образуется из элементарных частиц только трёх видов, является конечно же упрощённой. Однако, при рассмотрении общей структуры химической организации материи такое упрощение вполне оправдано – свойства атома и химический характер его взаимодействия с другими атомами можно объяснить тремя параметрами - числом протонов, нейтронов и электронов, содержащихся в нём.
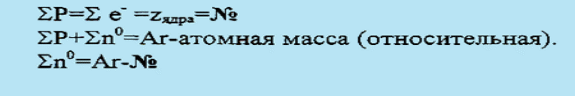
Хотя атомы образуются при взаимодействии всего трёх типов элементарных частиц, но при этом возникает набор самых разнообразных устойчивых или неустойчивых (радиоактивных) атомных систем. Все множество существующих в природе и искусственно синтезируемых атомов подразделяется на совокупности, в каждую из которых входят только атомы, характеризующиеся одним и тем же числом протонов, определяющим заряд ядра, которые называют химическими элементами.
В настоящее время известно более ста химических элементов. Каждый из них обозначается особым знаком (символом).
Наряду с понятием атома в настоящее время в химии широко используется более обобщающее понятие – атомная частица. Под атомной частицей понимают не только изолированный атом, но и производные от него: атомный радикал, атомный (одно атомный) ион, атомный ион-радикал, образующиеся вследствие ионизации или возбуждения атома и способный к самостоятельному существованию. В этом случае, соответствии с принятой классификацией к атомам можно отнести не все атомные системы, а только те, электронные конфигурации которых не содержат не спаренных электронов (например, атомы щелочноземельных элементов, благородных газов и д.р.). Все остальные изолированные атомы представляют собой, как правило, атомный радикал – атомы, имеющие не спаренные электроны в основном или возбуждённом состоянии. Так, например, атомные частицы бериллия в не возбуждённом состоянии имеют электронную конфигурацию 1s2 2s2, а в возбуждённом – 1s2 2s1 2p1. Это означает, что в соответствии с введённой классификацией изолированные атомные частицы бериллия в не возбуждённом состоянии относятся к атомам, а в возбуждённом – к радикалам, точнее к би радикалам, так как не спаренными в этом случае являются два электрона – 2s и 2р. Изолированные атомные частицы углерода уже в основном состоянии являются би радикалами – 1s2 2s2 2p2, а в возбуждённом радикалы углерода имеют уже четыре не спаренных электрона – 1s2 2s1 2p3.
Атомные ионы характеризуются наличием положительного или отрицательного заряда и одновременным отсутствием у такой атомной частицы не спаренных электронов.
Представителями атомных ион -радикалов являются ионы переходных металлов, содержащих в ионизированном состоянии также и не спаренные электроны.
Частицы |
Атом (молекула)
|
Радикалы |
Ион |
Ион-радикал
|
Атомные
|
He, Ar, Ca, Ba
|
H∙, Cl∙, Na∙ |
Na+, K+, Cl-, S2-
|
Fe2+., Cr+3., Mn2+. |
Следующим, более высоким уровнем химической организации материи после атома, является молекула.
Молекула – нейтральная по заряду наименьшая совокупность атомов, связанных в определённом порядке (т. е. обладающая определённой структурой), не имеющая, как правило, не спаренных электронов и способная к самостоятельному существованию.
Молекулы могут состоять как из атомов одного и того же элемента – гомо атомные, или гомо ядерные, так и из атомов различных элементов – гетеро атомные или гетеро ядерные.
Учитывая особенности электронного строения атомов (наличие или отсутствие заряда, наличие или отсутствие не спаренных электронов и т. д.), иногда вводят более широкое понятие – молекулярные частицы, при классификации которых необходимо выделять: молекулы (отсутствуют заряд и не спаренные электроны), молекулярные радикалы (отсутствует заряд, имеются не спаренные электроны), молекулярные ионы (имеется заряда, отсутствуют не спаренные электроны),– молекулярные ионы радикалы (имеется заряд, и не спаренные электроны).
Частицы |
Молела |
Радикалы |
Ион
|
Ион-радикал |
Молекулярные
|
Br2, N2, P4, S8 |
NO∙,NO2·, OH· |
NO3-, SO42-, NH4+, OH- |
O2- .,Cl2- ., Cl2- . |
Дальнейшее усложнение химической организации материи происходит при взаимодействии атомных и молекулярных частиц, ведущем к образованию более сложных совокупностей – молекулярных и
.
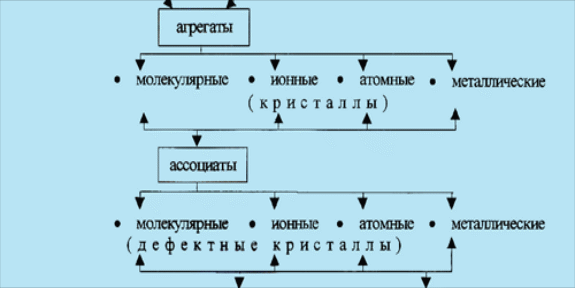
Важно отметить, что ассоциаты существуют главным образом в газообразном или жидком состоянии, а агрегаты – в твёрдом.
Молекулярные ассоциаты образуются из гомо ядерных или гетеро ядерных молекул. Атомные ассоциаты образуются из ядерных частиц, минуя второй, молекулярный уровень.
Образование атомных агрегатов может происходить по двум независимым механизмам: либо непосредственно из атомных частиц (минуя два уровня), либо за счёт взаимодействия атомных ассоциатов. Наиболее характерными примерами атомных агрегатов являются кристаллические атомные и металлические решётки.
Образование молекулярных агрегатов также происходит по двум механизмам: либо из молекулярных частиц, либо за счёт взаимодействия молекулярных ассоциатов. Примерами молекулярных агрегатов могут служить молекулярные и ионные кристаллические решётки. Отметим, что гомо ядерные молекулы и возникающие из них ассоциаты склонны к образованию только молекулярных кристаллических решёток, а гетеро ядерные – как молекулярных, так и ионных.
Существование тех или иных атомных или молекулярных совокупностей полностью определяется внешними условиями, изменение которых ведёт за собой и соответствующие изменения характера устойчивого образования.
Пример, , существующие в виде изолированных молекулярных частиц при температурах t≈400° C, по мере охлаждения превращаются в ассоциаты (Н2О)n, значение n в которых растёт тем больше, чем ниже температура. При температуре t<100°C ассоциаты укрупняются настолько, что образуют жидкую фазу - воду. Наконец при температурах t<0°C начинают формироваться агрегаты, свидетельством чего является образование твёрдой фазы – льда, который характеризуется уже совершенно новыми свойствами, присущими конденсированному состоянию.
Таким образом, по мере усложнения химической формы существования материи в ряду
(атомная частица) – (молекулярная частица) – (ассоциаты) – (агрегаты)
количественные изменения переходят в качественные.
Нарастание числа атомных единиц в их совокупности, приводящее к усложнению химической формы, постепенно придаёт каждой более сложной совокупности всё более разнообразный набор характеризующих её физико-химических свойств. Напротив, упрощение химической формы организации материи ведёт к уменьшению характеристического набора свойств. Иначе, между всеми подуровнями химической формы движения наблюдается такая же строгая иерархия.
