
- •Лабораторная работа №1 Скорость химических реакций
- •Экспериментальная часть Опыт 1. Влияние концентраций реагирующих веществ на скорость химической реакции в гомогенной системе.
- •Опыт 2. Влияние температуры на скорость химической реакции
- •Опыт 3. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе
- •Вопросы для самоконтроля
- •Лабораторная работа №2. Приготовление растворов различных концентраций.
- •1. Массовая доля и процентная концентрация.
- •2. Молярная концентрация (см )-
- •3. Молярная концентрация эквивалента (Сн) (нормальность).
- •4. Моляльная концентрация (Сm) (моляльность).
- •5. Титр раствора (т)
- •Экспериментальная часть. Опыт 1. Приготовление раствора соляной кислоты заданной концентрации.
- •Опыт 2. Определение концентрации кислоты методом титрования.
- •Результаты титрования
- •Опыт 3. Приготовление раствора соли с заданной массовой долей ( %)
- •Вопросы для самоконтроля.
- •Лабораторная работа № 3 Растворы электролитов
- •Экспериментальная часть
- •Лабораторная работа №4 Титрование сильной кислоты сильным основанием, слабой кислоты сильным основанием
- •Экспериментальная часть
- •Построение кривых кислотно-основного титрования
Экспериментальная часть
Опыт 1. Получение малорастворимых веществ.
а) В три пробирки внести по 2-3 капли следующих растворов:
в одну -сульфата натрия; в другую - сульфата цинка; в третью - сульфата алюминия. В каждую из пробирок добавить несколько капель раствора хлорида бария. Описать наблюдения. Написать молекулярные и общие ионно-молекулярное уравнения реакций.
б) В три пробирки внести по 2-3 капли следующих растворов:
в одну- соль меди (II); в другую соль никеля(II); в третью – соль кобальта(II). В каждую из пробирок добавить по 2-3 капли раствора гидроксида натрия. Описать наблюдения. Отметить цвет осадков.
Написать молекулярные и общие ионно-молекулярное уравнения реакций.
в) Пользуясь имеющимися в штативе реактивами, осуществить реакцию, выраженную следующим ионно-молекулярным уравнением:
Mg2+ + 2OH- = Mg(OH)2
Для опыта необходимо брать по 2-3 капли растворов.
Написать молекулярное уравнение реакции.
Опыт 2. Получение слабодиссоциирующих веществ.
Внести в пробирку 2-3 капли раствора ацетата натрия и добавить 2-3 капли 0,1н раствора хлороводородной кислоты, нагреть. Образующаяся при реакции уксусная кислота определяется по запаху.
Написать молекулярное и ионно-молекулярное уравнения реакции.
Опыт 3. Получение легколетучих веществ.
а) В две пробирки внести по 2-3 капли раствора карбоната натрия. В одну пробирку добавить несколько капель хлороводородной кислоты, в другую - уксусной кислоты.
Описать наблюдения.
Написать молекулярные и ионно-молекулярные уравнения реакций разложения слабой угольной кислоты на диоксид углерода и воду.
б) Пользуясь имеющимися в штативе реактивами, осуществить реакцию, выраженную следующим ионно-молекулярным уравнением:
NH4+ + OH- = NH4OH
Для опыта необходимо брать по 2-3 капли каждого раствора.
По запаху определить, какой газ выделяется. Написать молекулярное уравнение реакции.
Сделать общий вывод по работе. В каких случаях реакции между электролитами в растворах смещены в прямом направлении?
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ.
1. Напишите в молекулярной и ионной формах уравнения реакций между следующими веществами:
а)сульфидом натрия и серной кислотой;
б) хлористым аммонием и гидроксидом кальция;
в) сульфитом натрия и серной кислотой;
г) сульфидом железа (II) и хлороводородной кислотой;
д) гидроксидом бария и хлороводородной кислотой;
е) гидроксидом железа(III) и азотной кислотой;
ж) гидроксидом алюминия и едким натрием;
з) нитратом цинка и избытком едкого калия.
2. Допишите ионные уравнения реакций и составьте по ним молекулярные уравнения.
1) Ca2+ + CO32- = 5) Cu2+ + S2- =
2) H+ + CO32- = 6) Mg(OH)2 + 2H+ =
3) Ba2+ + SO42- = 7)Pb2+ + 2Cl- =
4) Cu2+ + H2S = 8) Ag+ + I- =
3. Осуществите следующие превращения:
а) Al2O3 AlCl3 Al(OH)3 Al(NO)3
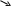
Na3AlO3
б) NH3 NH4OH NH4H2PO4 (NH4)2HPO4
Лабораторная работа №4 Титрование сильной кислоты сильным основанием, слабой кислоты сильным основанием
Благодаря большому скачку рН на кривой титрования и тому, что точка эквивалентности соответствует рН 7, сильные кислоты можно титровать сильными основания с индикаторами, значение рТ которых лежат как при рН<7, так и при рН>7.
Реактивы:
Соляная кислота, HCl, 0,1 М стандартный раствор.
Гидроксид натрия, NaOH, 0,1 М раствор.
Уксусная кислота, CH3COOH, 0,05 М раствор.
Индикаторы: 0,1% водный раствор метилового оранжевого;
0,1% спиртовой раствор фенолфталеина.
