
- •Гродно 2010
- •Природа химической связи
- •Вопрос 1. Развитие представлений о природе химической связи. Ее характеристики.
- •Вопрос 2. Свойства ковалентной связи.
- •Вопрос 3. Типы связей. Кратность связи.
- •Характеристика простых и кратных связей
- •Вопрос 4. Донорно-акцепторный механизм образования связи.
- •Вопрос 7. Полярность ковалентной связи.
- •Вопрос 8 Межмолекулярное взаимодействие
- •Вопрос 9. Метод молекулярных орбиталей (ммо).
- •230008, Г. Гродно, ул. Терешковой,28
- •230008, Г. Гродно, ул. Терешковой,28
Вопрос 2. Свойства ковалентной связи.
Ковалентная или иначе парно-электронная связь характеризуется насыщаемостью и направленностью. Под насыщаемостью понимают способность атомов образовывать ограниченное число ковалентных связей.
Под насыщаемостью ковалентной связи подразумевается невозможность присоединения других атомов к атому, у которого использованы все валентные электроны для образования электронных пар. Этим объясняется определенный состав устойчивых нейтральных молекул:
Н2, а не
Н3 или Н4, СН4 но не СН5
или СН6, НCl, а не
Н2Cl.
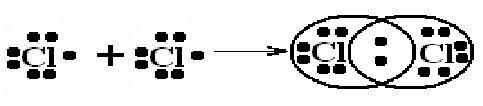
Направленность ковалентной связи обусловлена тем, что перекрывание валентных электронных облаков возможно только при их определенной взаимной ориентации. Направленность обусловливает пространственную структуру молекул, т.е. их форму.
Рассмотрим на примере образования молекулы Н2О, которая, как известно, имеет угловое строение
H

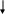
 1s¹ 2s 2p
1s¹ 2s 2p
O 1s² 2s² 2p²
H 1s¹ px py pz
У двух непарных электронов различные магнитные квантовые числа (0, -1), орбитали их взаимно перпендикулярны, т.е. располагаются относительно друг друга под углом 90 градусов.
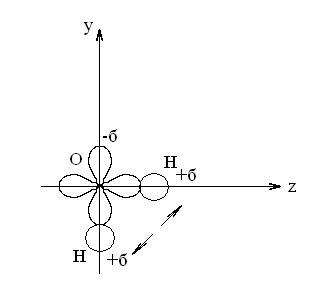
На внешнем уровне атома кислорода имеются два неспаренных электрона. При образовании молекулы воды орбиталь каждого р-электрона кислорода перекрывается орбиталью 1s-электрона атома водорода вдоль линии осей координат. Химические связи в этом случае должны быть направлены под углом 90 градусов. Экспериментально установлено, что угол между связями в молекуле воды 104˚,5´ градусов, что объясняется расталкиванием эффективных положительных зарядов атомов водорода, а так же электронных облаков.
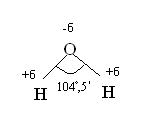
В молекуле воды связь О - Н ковалентная полярная. На атоме водорода эффективный положительный заряд +δ, а на атоме кислорода –δ.
Вопрос 3. Типы связей. Кратность связи.
Метод валентных связей основан на положении, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких электронных пар. И химическая связь между ними тем прочнее, чем сильнее перекрываются электронные облака атомов
Орбитали
перекрываются таким образом, чтобы
обеспечивать максимальное их взаимное
проникновение. При этом условии химическая
связь будет наиболее прочной. Если
перекрывание происходит вдоль линии,
соединяющей ядра атомов, то такая связь
называется сигма связью ( σ –связь),
σ![]() -
греческая буква, соответствующая
латинской s , (s-
орбитали могут образовывать только σ
- связи). σ - связи могут образовываться
так же при перекрывании s
- p и p - p
орбиталей.
-
греческая буква, соответствующая
латинской s , (s-
орбитали могут образовывать только σ
- связи). σ - связи могут образовываться
так же при перекрывании s
- p и p - p
орбиталей.
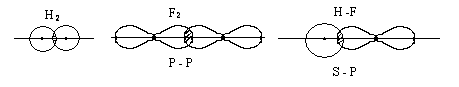
Химическая связь, осуществляемая одной электронной парой, называется одинарной. Одинарная связь - всегда σ - связь. Но связь двух атомов может осуществляться более чем одной парой электронов. Такая связь называется кратной.
Пример образования кратной связи -
молекула азота.
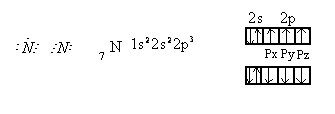
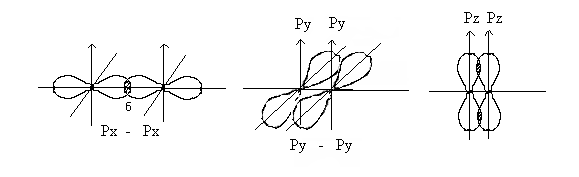


В молекуле азота рх орбитали образуют одну σ – связь.
При образовании связи ру и рz- орбитали образуют две области перекрывания выше и ниже линии, проходящей через ядра атомов, такая связь называется π –связью (π - греческая буква соответствует латинской р). π –связь образуется, если возникают две области перекрывания выше и ниже линии, проходящей через ядра атомов. При образовании π -связей электронные облака перекрываются меньше, чем в случае σ -связей. Вследствие этого π - связи, как правило, менее прочны, чем σ-связи, образованные теми же атомными орбиталями. Орбитали типа р могут образовывать как σ так и π - связи. В кратных связях одна из них σ – связь, остальные π - связи.
Т.о. кратность связи определяется числом общих электронных пар, участвующих в образовании связи. Если одна общая электронная пара возникла между атомами-то ковалентная связь одинарная, две - двойная, три - тройная.
Увеличение кратности связи приводит к уменьшению межъядерного расстояния.
