
- •Гродно 2010
- •Природа химической связи
- •Вопрос 1. Развитие представлений о природе химической связи. Ее характеристики.
- •Вопрос 2. Свойства ковалентной связи.
- •Вопрос 3. Типы связей. Кратность связи.
- •Характеристика простых и кратных связей
- •Вопрос 4. Донорно-акцепторный механизм образования связи.
- •Вопрос 7. Полярность ковалентной связи.
- •Вопрос 8 Межмолекулярное взаимодействие
- •Вопрос 9. Метод молекулярных орбиталей (ммо).
- •230008, Г. Гродно, ул. Терешковой,28
- •230008, Г. Гродно, ул. Терешковой,28
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА
И ПРОДОВОЛЬСТВИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УО “ГРОДНЕНСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ”
КАФЕДРА ХИМИИ
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Лекция: Природа химической связи
Для студентов аграрных специальностей

Гродно 2010
УДК: 546 (076.5)
ББК 24.1 Я 73
Р 13
Рецензенты: доктор биологических наук, профессор кафедры химии Учреждения образования «Гродненский государственный аграрный университет» З.В. Горбач, кандидат химических наук, доцент кафедры общей и неорганической химии Учреждения образования «Белорусский государственный технологический университет» Л.И.Хмылко.
Апанович, З.В.
Р 13
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического, ветеринарного и факультета защиты растений. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
УДК: 546 (076.5) ББК
24.1 Я 73
Рекомендовано межфакультетской методической комиссией инженерно–технологического факультета 30 сентября 2010г. (протокол № 1).
© УО «Гродненский государственный аграрный университет»,2010
© Апанович З.В.,2010
Природа химической связи
ВОПРОСЫ:
1) Развитие представлений о природе химической связи. Ее характеристики.
2) Свойства ковалентной связи.
3) Типы связей. Кратность связи.
4) Определение валентности по методу валентных связей (МВС).
5)Донорно-акцепторный механизм образования ковалентной связи.
6)Гибридизация атомных орбиталей (АО).
Делокализованная π- связь.
7) Полярность ковалентной связи.
8) Межмолекулярное взаимодействие. Водородная связь.
9) Понятие о методе молекулярных орбиталей (ММО).
Вопрос 1. Развитие представлений о природе химической связи. Ее характеристики.
Все вещества образуются в результате возникновения между атомами, входящими в их состав, прочных связей, называемых химическими. Все химические процессы происходят в результате перегруппировок атомов, сопровождающихся разрывом старых связей между ними и образованием новых. Не существует химических реакций, в ходе которых связи между атомами не изменялись бы. Поэтому вопрос о природе химической связи всегда считался важнейшим вопросом химии. Какова природа сил, связывающих атомы в молекулы? В начале XIX века французский ученый Бертолле и шведский ученый Бергман предположили, что характер этих сил гравитационный (взаимодействие масс атомов).
Гравитационная теория сменилась первой электрохимической теорией, предложенной шведским ученым Берцеллиусом. Он полагал, что различные атомы обладают противоположными электрическими зарядами, благодаря чему между ними возникает электростатическое притяжение. Однако и эта теория была отвергнута, т.к. не объясняла образования молекул из одинаковых атомов, но тем не менее она ближе к современной.
Большим вкладом в развитие представлений о строении молекул явилась теория химического строения Бутлерова (разработанная в 1861 г.).
Однако только после открытия электронного строения атомов удалось решить вопрос о природе химической связи. Впервые немецкий ученый Коссель в 1916г. предположил, что при взаимодействии атомов, один из них отдает, а другой принимает электроны. В том же году американским ученым Льюисом предложена теория образования химической связи с помощью электронных пар, принадлежащих одновременно двум атомам. Современное учение о химической связи развивалось на основе работ Косселя и Льюиса.
Главной причиной возникновения химических связей между атомами является понижение полной энергии системы при переходе от свободных взаимодействующих атомов к молекуле.
Природа химической связи по современным представлениям электрическая, объясняется взаимодействием электрических полей, образуемых электронами и ядрами атомов, участвующих в создании молекулы.
Любая молекула обладает меньшим запасом энергии, чем совокупность атомов, из которых она образуется. Из этого следует, что при образовании молекул из атомов энергия выделяется, в количестве, которое необходимо для разложения молекулы на атомы. Количественной характеристикой прочности связи является - энергия связи (Е) она равна работе, которую необходимо затратить на разрыв связи.
Н2 = Н + Н ЕН2 = 435 кДж/моль
В молекуле водорода энергия связи высока, что объясняется небольшими размерами взаимодействующих атомов.
Геометрической характеристикой является длина связи (r0) - межъядерное расстояние между химически связанными атомами, когда силы притяжения уравновешены силами отталкивания и энергия системы минимальна.
Для молекулы Н2 r0 = 0,074 нм.
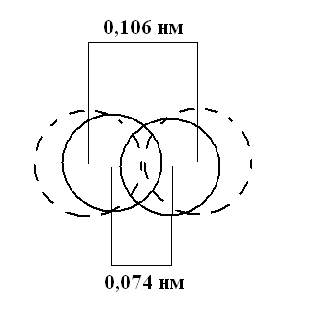
Различают 3 основных типа химических связей:
-ковалентную
-ионную
-металлическую
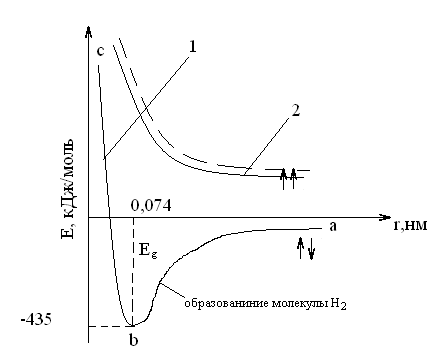
Зависимость потенциальной энергии Е системы из двух атомов водорода от межъядерного расстояния r0.
.
При образовании химических связей понижается потенциальная энергия.
Минимум на прямой 1 соответствует энергии связи в молекуле Н2 (максимальная энергия, выделяющаяся при ее образовании) и минимально возможному расстоянию между ядрами (длина связи), когда силы притяжения уравновешены силами отталкивания. Если спины электронов параллельны (2) потенциальная энергия системы из двух атомов непрерывно возрастает при их сближении и следовательно химическая связь не образуется
Кривая (1) состоит из двух ветвей: ab - притяжения, bc – отталкивания атомов.
Химическая связь, осуществляемая электронными парами, называется ковалентной. Это двуцентровая (удерживает 2 ядра), двухэлектронная связь. Соединения с ковалентной связью называются гомеополярными или атомными. Связь образованная общей электронной парой, в равной мере принадлежащей двум одинаковым атомам называется ковалентной неполярной, а разным атомам – ковалентной полярной.
Химические связи часто изображают электронно- структурными схемам, где внешние электроны атомов обозначают точками у символа элемента. Ковалентную связь изображают черточкой (штрихом) которая символизирует пару электронов.
Основным условием образования химической связи является понижение полной энергии Е многоатомной системы по сравнению с энергией изолированных атомов, т.е. ЕАВ <ЕА +ЕВ в случае, если образуется вещество АВ из атомов (А + В = АВ)
