
- •Часть 3
- •Растворимость. Способы выражения состава растворов Краткие теоретические сведения
- •Примеры решения задач
- •156, 2 Г раствора — 100,0 г н2о;
- •50,0 Г раствора — m1 г н2о;
- •1 Моль (278 г) FeSo4 ·7h2о содержит 1 моль (152 г) FeSo4 ;
- •50 Г FeSo4 ·7h2о содержит m2 г FeSo4 ;
- •Разбавленные растворы неэлектролитов Краткие теоретические сведения
- •Примеры решения задач
- •Растворы электролитов Краткие теоретические сведения
- •Примеры решения задач
- •Ионное произведение воды. Буферные растворы Краткие теоретические сведения
- •Примеры решения задач
- •Произведение растворимости Краткие теоретические сведения
- •Выражение для произведения растворимости имеет вид
- •Примеры решения задач
- •Гидролиз солей Краткие теоретические сведения
- •Примеры решения задач
- •Список литературы
- •Содержание
Примеры решения задач
Пример 1. Раствор содержит 0,85 г хлорида цинка и 125 г воды, которая кристаллизуется при температуре –0,23 °С. Рассчитайте кажущуюся степень диссоциации хлорида цинка в данном растворе.
Р е ш е н и е
Температура замерзания чистой воды равна Т = 0 С, тогда
DTзам = Т – Tзам = 0 – (–0,23) = 0,23 °С.
Моляльность раствора рассчитаем по формуле (3)
![]() .
.
Изотонический коэффициент для данного раствора определяем из формулы (36)
![]() .
.
Для соли CaCl2 = 3, тогда по уравнению (33) кажущаяся степень диссоциации равна
=
![]() .
.
Пример 2.Определите концентрацию ионов ОН– в 0,01 М растворе гидроксида аммония, если КД(NH4OH) = 1,77 · 10-5.
Р е ш е н и е
Данный электролит
в водном растворе диссоциирует обратимо
по схеме NH4OH
NH![]() + ОН–.
Поскольку КД(NH4OH)
<< 1, значит гидроксид аммония очень
слабый электролит. Тогда для определения
степени диссоциации NH4ОН
можно использовать формулу (25)
+ ОН–.
Поскольку КД(NH4OH)
<< 1, значит гидроксид аммония очень
слабый электролит. Тогда для определения
степени диссоциации NH4ОН
можно использовать формулу (25)
=
![]() .
.
Концентрацию ионов ОН– найдем по уравнению (20)
[ОН–] = n C2 = 1 0,042 0,01 = 4,2 · 10-4.
Пример 3. Вычислите
концентрацию ионов ОН ˉ в растворе,
содержащем смесь NH4OH
(С2
= 0,2 M)
и NH4Сl
(С![]() = 1 M),
КД(NH4OH)
= = 1,77 · 10-5.
= 1 M),
КД(NH4OH)
= = 1,77 · 10-5.
Р е ш е н и е
Концентрация ионов ОН ˉ определяется уравнением диссоциации слабого электролита по схеме NH4OH Û NH4+ + OH ˉ .
Выражение для
константы диссоциации имеет вид KД
=
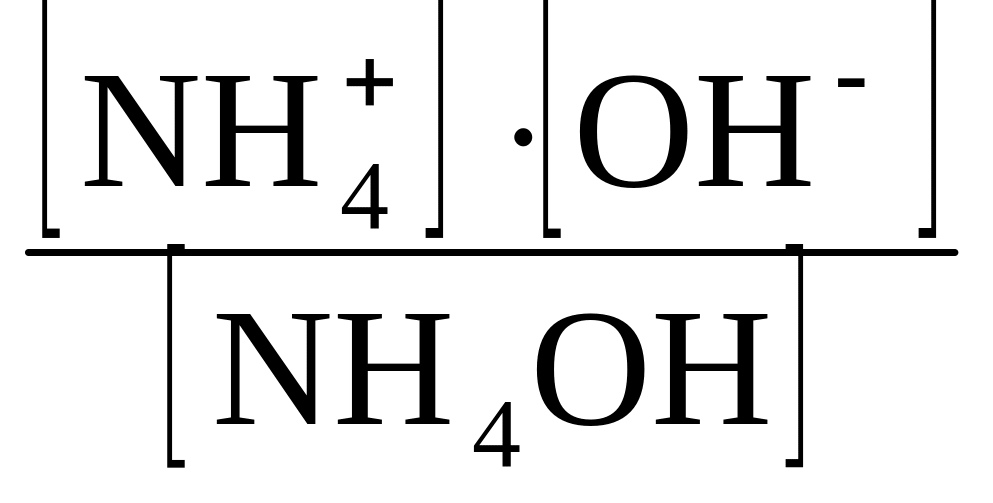 .
.
Тогда
[ОН ˉ]
=
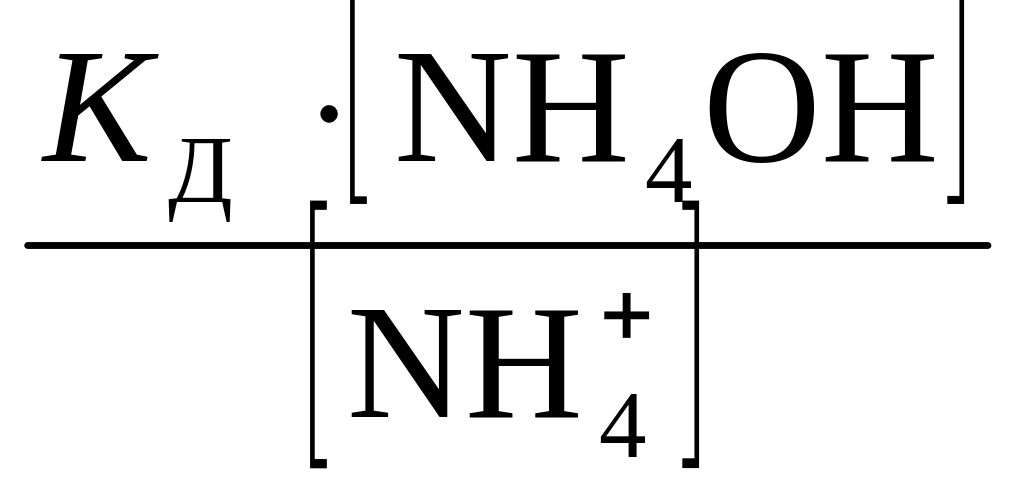 .
.
NH4Сl – сильный электролит, диссоциирует на ионы полностью по схеме NH4Cl NH + Cl–. Тогда [NH4+] = С = 1 моль/л, поскольку концентрацией ионов NH , полученной за счет диссоциации слабого электролита NH4OH, можно пренебречь. Отсюда
[ОН
–]
=
![]() = 3,6×10-6
моль/дм3.
= 3,6×10-6
моль/дм3.
Пример 4. Рассчитайте концентрации ионов в 0,01 М растворе K2SO4.
Р е ш е н и е
K2SO4
– сильный
электролит,
диссоциирует
по уравнению
K2SO4 2K+
+ SO![]() .
Следовательно, концентрации ионов
определяем по формуле (21)
.
Следовательно, концентрации ионов
определяем по формуле (21)
K+
= 2 С2
= 2
0,01 = 0,02 моль/дм3;
SO![]()
= С2
= 0,01
моль/дм3.
= С2
= 0,01
моль/дм3.
Пример 5. Рассчитайте активность ионов водорода в 0,03 М растворе серной кислоты.
Р е ш е н и е
Н2SO4
− сильная двухосновная кислота, которая
полностью распадается на ионы по
уравнению Н2SO4
→ 2H+
+ SO![]() .
Тогда концентрации ионов из формулы
(21) равны Н+
= 2 0,03
= 0,06 М; SO
=
0,03 М. Ионную
силу раствора рассчитаем по формуле
(32)
.
Тогда концентрации ионов из формулы
(21) равны Н+
= 2 0,03
= 0,06 М; SO
=
0,03 М. Ионную
силу раствора рассчитаем по формуле
(32)
I = ½ (0,06·12 + 0,03 · 22) = 0,09.
Коэффициент активности γ(Н+) найдем из справочника [8]. Для ионной силы I = 0,09 коэффициент активности однозарядного иона γ+ = 0,847. Тогда по формуле (26)
а![]() = [Н+]
+
= 0,06 0,847
= 0,051 М.
= [Н+]
+
= 0,06 0,847
= 0,051 М.
Пример 6. Определите активность нитрата стронция в растворе с концентрацией 0,06 моль/кг?
Р е ш е н и е
Sr(NO3)2
диссоциирует
по уравнению Sr(NO3)2 Sr2+ + 2![]() .
Так как Сm = 0,06
моль/кг,
то
равновесные концентрации ионов равны
.
Так как Сm = 0,06
моль/кг,
то
равновесные концентрации ионов равны
Sr2+
= 0,06 моль/кг; ![]()
= 2
0,06 = 0,12 моль/кг.
= 2
0,06 = 0,12 моль/кг.
По уравнению (32) находим ионную силу раствора
I
= 1/2
([Sr2+]
z![]() + [
]
z
+ [
]
z![]() )
= 1/2(0,0622
+ 0,1212)
= 0,18.
)
= 1/2(0,0622
+ 0,1212)
= 0,18.
По формуле (31) вычисляем средний ионный коэффициент активности электролита
lg
= – 0,5
= – 0,52
1![]() = –0,424.
= –0,424.
Следовательно, f = 10–0,424 = 0,376.
Среднюю ионную моляльность электролита найдем по формуле (30)
С
=
![]() .
.
Активность Sr(NO3)2 оцениваем по уравнению (27)
а2
=
![]() моль/кг.
моль/кг.
