
- •Лекция 2
- •Что такое структура атома?
- •Химические связи.
- •Ковалентная связь в Si
- •Агрегатные состояния. Перечисленные виды связей различны по прочности и в значительной мере они зависят условий, в которых данное вещество находится.
- •Квант - фонон
- •Электронные состояния в кристаллах. Электроны в периодическом потенциальном поле.
- •Основы зонной теории твердого тела.
Ковалентная связь в Si
Из периодической системы элементов Д.И.Менделеева находим, что атом Si на уровне 3р имеет два электрона и вакансии для четырех электронов. Каждый атом Si в твердом состоянии стремится притянуть по одному е- от каждого из
четырех соседних атомов для того, чтобы иметь заполненную оболочку 3р. Поскольку не существует преимущественного выбора атомов, каждый атом Si стремится дополнить свои два 3s - электрона и два 3р электрона в такой же мере, как и соседние атомы.
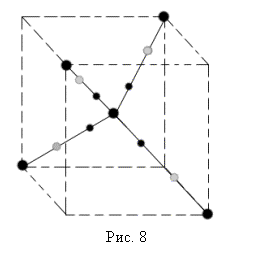
Если кремний находится в твердом состоянии, его атомы расположены в пространстве некоторым регулярным образом и образуют кристаллическую структуру. Трехмерная картина ковалентных связей изображена на рис. 8.
В том случае, когда валентные е- участвуют в образовании связи, как это показано на рис., вещество ведет себя подобно диэлектрику (для Si это наблюдается при Т0 около 00К). Приток тепловой (с ???????????? Т0) или лучистой энергии разрывает ковалентные связи, освобождая электроны. Энергия, необходимая для разрыва одной связи в атоме Si составляет примерно 1.1 эВ! Связь атома Si с четырьмя соседними атомами (черными кружками изображены 4 валентных е- принадлежащих центральному атому, светлые - е-, принадлежащие и соседним атомам).
Молекулярная связь (связь Ван-дер-Ваальса) возникает у веществ между молекулами с ковалентным характером внутримолекулярного взаимодействия при согласованном движении валентных электронов в соседних молекулах. Молекулярные связи существуют между отдельными молекулами за счет электростатического притяжения имеющимися в них зарядами противоположных знаков (силы Ван-дер-Ваальса). Эти связи удерживают вместе молекулы в твердом водороде (H2), азоте (N2), углекислом газе (СО2), во многих органических соединениях — полиэтилене, политетрафторэтилене и т. д. Ввиду слабости молекулярных связей эти вещества легко разрушаются при тепловом движении молекул и имеют низкие температуры плавления и кипения.
Особым видом молекулярной связи является водородная связь, осуществляемая через ион водорода (протон), расположенный между двумя ионами (О2–, F–, С1–) соседних молекул. Водородная связь имеется в воде Н2О и некоторых органических соединениях, а также в кристаллах типа КН2Р04.
Агрегатные состояния. Перечисленные виды связей различны по прочности и в значительной мере они зависят условий, в которых данное вещество находится.
В частности, всякое вещество, как известно, может находится в твёрдом, жидком и газообразным состояниях. Эти состояния называются агрегатными состояниями вещества. Агрегатные состояния вещества это состояния одного и того же вещества ( напр. , воды, железа,серы), переходы между которыми сопровождаются скачкообразными изменениями свободной энергии, энтропии, плотности и др. основных физических свойств. Так , вода при нормальном давлении 760 мм рт.ст. и при 0оС кристаллизуется в лёд, а при 100градС кипит и превращается в пар. Следовательно вода может существовать в твёрдом, жидком и газообразном агрегатном состоянии.
Существование нескольких агр. состояний обусловлено различиями в характере теплового движения молекул( атомов) вещества и их взаимодействий.
В газах молекулы почти не взаимодействуют друг с другом и движутся свободно, заполняя весь объём , в котором газ находится.
У жидкостей и твёрдых тел – конденсированных систем – молекулы (атомы) расположены близко друг от друга и взаимодействуют со значительными силами. Это приводит к сохранению жидкостями и твёрдыми телами определённого объёма. Однако характер движения молекул в жидкостях и в твёрдых телах различен, чем объясняются различие их структуры и свойств. У твёрдых тел в кристаллическом состоянии атомы совершают лишь небольшие колебания вблизи узлов крист. решётки; структура этих тел характеризуется высокой степенью упорядоченности – дальним порядком в расположении атомов. Тв. тело – это более упорядоченная система, чем жидкость. Тепловое движение молекул жидкости представляет сочетание малых колебаний около положения равновесия и частых перескоков из одного положения равновесия в другое. Последние и обуславливают существование в жидкости лишь ближнего порядка в расположении молекул (атомов) , а также свойственные жидкому состоянию подвижность и текучесть. Тв. тела сохраняют не только объём , но и форму ( в отличие от жидкостей). У них имеется конкретная величина напряжения сдвига и др. прочностных параметров.
Плазму выделяют в особое агр. состояние вещества в связи с тем, что заряженные частицы плазмы, в отличие от нейтральных молекул обычного газа, взаимодействуют друг с другом на больших расстояниях. Этим объясняется ряд своеобразных свойств плазмы.
Переходы из одного агр. состояния в другое обычно сопровождаются скачкообразным изменением их св. энергии, плотности и др. физических величин. Однако бывают исключения, когда переходы из более упорядоченного по структуре агр. состояния в менее упорядоченное могут происходить как скачком при определённых температурах и давлении ( плавление, кипение), так и непрерывно. Возможность непрерывных переходов ( напр. Жидкости в пар) указывает на некоторую условность выделения агр. состояния веществ. Эта условность подтверждается существованием тв. аморфных веществ, сохранивших структуру жидкости; нескольких видов крист. состояния у ряда веществ; жидких кристаллов; существование у полимеров особого высокоэластического состояния, промежуточного между стеклообразным и жидким и др. явлениями. В связи с этим в современной физике вместо понятия агр. состояние пользуются более широким понятием – фазы.
Объектом нашего изучения , в основном, – твёрдое тело.
Твёрдое тело – основной материал, используемый человеком.
Можно сформулировать несколько характерных особенностей тв . тел как физических объектов, состоящих из огромного количества( макроскопического) атомных частиц и электронов.
1). Атомы, молекулы и ионы – это структурные единицы тв. тела, т.е. энергия взаимодействия между ними мала по сравнению с энергией, которую надо затратить на разрушение самой структурной единицы. Но при этом энергия их взаимодействия велика по сравнению с энергией их теплового движения ( в газах обратное соотношение). В тех случаях, когда энергия теплового движения оказывается порядка или больше энергии взаимодействия между структурными единицами, в тв. теле происходит перестройка структуры.
2). Тв. тела характеризуются большим разнообразием сил, действующих между частицами, а также их движений.
Движения атомных частиц в тв. теле проявляются в различных его свойствах. Все движения можно разделить на три типа: а). Диффузия – флуктуационное перемещение атома из занятого им положения в соседнее – свободное. Как правило, время оседлой жизни атома значительно больше, чем время перемещения – атом совершает редкие скачки, вероятность которых возрастает с ростом температуры. Диффузионное перемещение – сравнительно редкий пример классического движения атомов в тв. теле. б). Коллективные движения частиц, простейший пример которых – колебания кристаллической решётки. Энергия движения колеблющихся атомов приближённо равна сумме энергий отдельных колебаний. Эти колебания не превышают атомный масштаб. В). При низких температурах ( вблизи Т=0К) атомные частицы могут совершать движение квантовое по своей природе, но макроскопическое по масштабу. Наиболее изучено движение электронов в сверхпроводниках и атомов в сверхтекучем гелии. Характерная черта сверхпроводящего и сверхтекучего движения – строгая согласованность в поведении частиц, обусловленная взаимодействием между ними. Для выхода из такого коллектива частица должна преодолеть некоторую энергию ( энергетическую щель).Существование этой щели делает сверхроводящее и сверхтекучее движение устойчивым.
3). Знание атомной структуры тв. тела и характер движения частиц в нём позволяет установить какие квазичастицы ответственны за то или др. явление или свойство. Например, высокая электропроводность металлов обусловлены электронами проводимости, а теплопроводность – электронами проводимости и фононами, ферромагнитный резонанс – магнонами и т.д. Отличие колич. характеристик различных движений позволяет отделить одно движение от другого. Например, из–за большого различия в массах скорость движения ионов в металлах и полупроводниках очень мала по сравнению со скоростью электронов. Поэтому в некотором приближении рассматривая движение электронов, ионы можно считать неподвижными.
4). Все тв. тела при достаточном повышении температуры плавятся ( или возгоняются). Подводимая к телу в процессе плавления теплота тратится на разрыв межатомных связей. Температура плавления , характеризующая силу связи ат. частиц в тв . телах различна: у молек. водорода Тпл = –259°.С, а у графита более 4000 °С, у вольфрама – 3410 +– 20градС.
При изменении внешних условий ( давления, температуры, магнитного поля и т.д.) в тв. теле происходят скачкообразные изменения структуры и свойств – фазовые переходы. Для тв. тел характерен полиморфизм – наличие различных устойчивых кристаллических структур ( модификаций), например, графит и алмаз, белое и серое олово. Обнаружено большое количество различных существующих при больших давлениях кристаллических модификаций, многие из которых отличаются физическими свойствами. Например, висмут под давлением образует три сверхпроводящие модификации: при 25300 – 27000 атм. и Т= 3,93°.С; при 27000–80000 атм и Т= 6,9°.С и при менее 80000 и Т=7 °.С. Многие полупроводники под давлением переходят в металлическое состояние ( германий при 120000 атм. становится металлом), а иттербий ( металл) становится полупроводником.
Знание атомно–молекулярной структуры тв. тела, характера движения составляющих его частиц объясняет наблюдаемые явления и позволяет предсказать ещё не открытые свойства тв. тела., а также целенаправленно изменять структуру тв. тела и синтезировать тв. тела с уникальным набором свойств.
Строение и структура твёрдых тел.
Многие свойства твердых тел объясняются той периодичностью, с которой размещены в пространстве их структурные элементы. Поэтому введено такое понятие как кристаллическая решетка.
В периодической кристаллической решетке можно выделить некоторую элементарную ячейку, которая повторяется периодически по всему кристаллу. Выделяя такую ячейку, удается описать положения атомов и ионов в веществе и, следовательно, она может служить для того, чтобы с ее помощью характеризовать структуру кристаллов. Положения занимаемые атомами или ионами называют точками (узлами) решетки.
Элементарные ячейки:
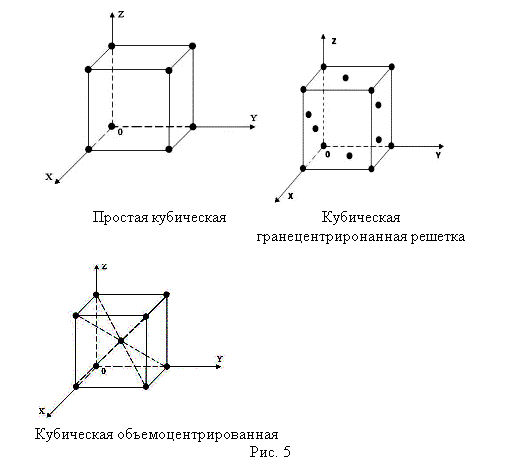
Рис. 2.4.
Кристаллическую решетку твердых тел принято изображать моделью упорядоченной периодической структуры как на рис. 2.5.
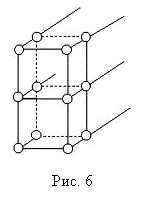
Рис.2.5.
Данная модель "мертвая": в ней нет никаких видов движения. Конечно, атомы твердых тел столь сильно влияют друг на друга (если бы они не взаимодействовали, то был бы не кристалл, а газ, состоящий из беспорядочно движущихся атомов), что практически лишены возможности перемещаться. Однако., если кристалл находится при некоторой конечной температуре, то составляющие его атомы обязаны совершать тепловые колебания. Атомы не в силах разорвать их связь с ближайшими соседями, и обречены совершать только "бег на месте", что напоминает движение маятника, только в трех плоскостях! Иногда они раскачиваются столь сильно, что покидают свое положение равновесия, но это происходит редко.
Атомы движутся всегда, причем чем выше температура, тем больше амплитуда их колебаний. Но, пожалуй, самое существенное отличие атома, колеблющегося вокруг положения равновесия, от обычного "классического маятника" состоит в том, что атом - "квантовый маятник". В отличие от "классического маятника" "квантовый маятник" может менять свою энергию лишь порциями, квантами.
Энергия "квантового маятника" квантуется на порции, величина которых (ΔЕ=hv), где h=6.62*10-34Дж/c - постоянная Планка, v - частота, с которой колеблется маятник. Таким образом, последовательность значений энергии, которую может иметь атом, колеблющийся вокруг положения равновесия, образует как бы "энергетическую лесенку", ступеньки которой отстоят друг от друга на расстоянии ΔE близка к k*T - полной энергии колеблющегося атома, и поэтому квантовость поглощения энергии атомом не может не сказаться и на его "личных" характеристиках, и на характеристиках твердого тела, состоящего из совокупности атомов - "квантовых маятников".
Идеи квантового описания колебаний атомов внесли и свои особенности. С классической точки зрения амплитуда колебаний атомов при ↓T 0 будет уменьшаться, а при T=00К атомы и вовсе остановятся. С точки же зрения квантовых законов оказывается, что даже при абсолютном нуле температуры атомы в твердом теле совершают колебания. Их так и называют - нулевые колебания атомов.
Нулевые колебания атомов происходят и при иной, более высокой температуре, одновременно с обычными колебаниями и обнаруживают себя во многих физических явлениях, главным образом в так называемых "квантовых кристаллах", у которых амплитуда нулевых колебаний близка к межатомному расстоянию и даже превосходит его. Это кристаллы, для которых характерна малая энергия связи, и существуют они в области низких температур.
Колебания сильно взаимодействующих атомов можно представить как совокупность слабо взаимодействующих волн. В основе такого перехода лежит идея (ее сформулировал еще в 1923г французский физик Луи де Бройль) о том, что каждой волне можно сопоставить частицу, энергия которой равна Э=hv=hV/, где V - скорость распространения волны, а - ее длина. Это обстоятельство позволяет создать удобный и наглядный язык для описания поведения атомов твердого тела, что особенно необходимо при низких температурах.
Для иллюстрации рассмотрим с позиций квантовой механики типичную ситуацию, возникающую в кристалле. Кристалл - совокупность правильно (или близко к этому) расположенных взаимодействующих друг с другом атомов. Все эти атомы подобны колебательным контурам, настроенным на одинаковые частоты колебаний и способным резонировать друг с другом.
Поэтому, любое возбуждение одного атома вызывает аналогичное возбуждение атомов - соседей.

Представьте себе систему шариков, связанных между собой пружинками, как это показано на рис.9. Как только мы качнем один шарик, он сдвинет с места соседний, тот толкнет соседа и т.д. По системе шариков и пружин побежит волна! Эти волны очень хорошо иллюстрируют движение атомов в твердом теле. Из-за взаимодействия атомы не могут двигаться независимо друг от друга. Возбуждения распространяются в кристалле в виде волны. Однако согласно законам квантовой механики движение, которое связано с этими волнами, возникает и передается в виде отдельных порций - квантов. Такие кванты, связанные с коллективным возбуждением всего кристалла ведут себя во многих отношениях подобно обычным частицам. Они получили название "квазичастицы" (почти частицы).
Квазичастицы являются носителями движения в системе взаимодействующих атомов в том смысле, что энергия твердого тела равна сумме энергии отдельных квазичастиц.
