
- •Лекция 2
- •Что такое структура атома?
- •Химические связи.
- •Ковалентная связь в Si
- •Агрегатные состояния. Перечисленные виды связей различны по прочности и в значительной мере они зависят условий, в которых данное вещество находится.
- •Квант - фонон
- •Электронные состояния в кристаллах. Электроны в периодическом потенциальном поле.
- •Основы зонной теории твердого тела.
Лекция 2
Строение вещества , как основа , обуславливающая их свойства
Все свойства веществ могут быть поняты на основе знания их атомно–молекулярного строения, законов движения атомных (атомов, молекул, ионов) и субатомных (электронов, атомных ядер) частиц. Исследования их взаимосвязей объединились в большую область современной физики – физику твёрдого тела, развитие которой стимулируется потребностями практики, гл. образом техники.
Всё огромное многообразие веществ обусловлено различным сочетанием атомов в молекулах . Атом – мельчайшая частица химического элемента, сохраняющая свойства этого элемента. Атомы могут существовать в свободном состоянии и в соединениях с атомами того же или других элементов.
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в кулоновском поле. Суммарный заряд электронов в атоме по абсолютной величине равен заряду ядра. Атом электронейтрален. Ядро состоит из протонов и нейтронов.
Атомы химических элементов образуют молекулы. Химические вещества, состоящие из молекул, образованных атомами одного элемента, носят название простых веществ. Химические вещества из молекул, образованных атомами различных элементов наз–ся сложными веществами ( органические и неорганические). Полное описание свойств материалов определяется состоянием перечисленных элементарных частиц в любой момент времени при конкретных условиях. Строение атомов существенно для исследования электронных свойств .
Основную роль в процессе объединения атомов в кристалл играют электроны. В квантовой механике движение электронов описывается волновой функцией, обладающей в изолированном атоме водорода сферической симметрией, так что заряд электрона как бы диффузно распределён, образуя размытое облако.
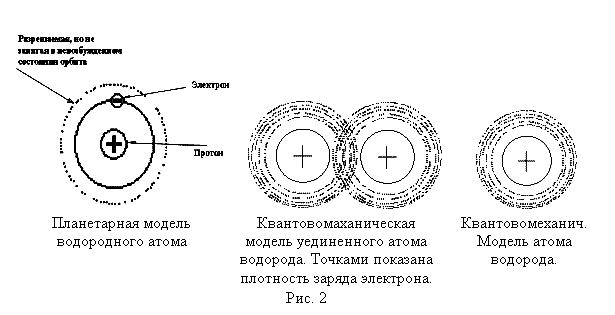
Рис. 2.1.
Что такое структура атома?
Этим понятием обозначается характер упорядоченности элементарных частиц, составляющих атом,- электронов, протонов и нейтронов. С точки зрения определения электрических, физических и химических свойств материалов наиболее важными являются знаниями об упорядоченности электронов, т.е. о структуре электронной оболочки атома. Упорядоченность нейтронов и протонов в ядре очень мало влияет на важнейшие свойства материалов.
Электроны в электронной оболочке располагаются в соответствии с определёнными закономерностями. Энергетическое состояние каждого электрона характеризуется набором из четырёх квантовых чисел. При этом в соответствии с принципом Паули в электронной оболочке не может быть двух электронов, у которых все четыре квантовых числа одинаковы. Квантовые числа и энергия электронов могут принимать лишь дискретные значения.
Электронная оболочка каждого атома состоит из определённого числа слоёв, причем каждый слой соответствует определённому значению главного квантового числа n. Это число может приобретать значения натуральных чисел 1, 2, 3 и т.д. Иногда эти слои обозначаются буквами K, L, M и т.д.
Второе квантовое
число (или
орбитально-квантовое число) l
может приобретать значения 0, 1, 2, 3...
(n-1),
где n значение главного квантового
числа. Электроны на этих орбитах находятся
в энергетических состояниях, которые
обозначаются буквами s, p, d, f. Электроны
на орбитах могут отличаться только
значением третьего
квантового числа
(m)(или
ml)
(магнитного орбитального квантового
числа, которое может принимать значения
-l,
..., 0, ...,+l
где l
-значение второго квантового числа) или
значением четвёртого
квантового числа
ms,
которое может принимать только значения
+![]() и -
и называется спиновым
квантовым числом.
и -
и называется спиновым
квантовым числом.
От структуры электронной оболочки атомов зависят многие свойства веществ. Решающее влияние имеют внешние, наиболее удалённые от ядра электроны. Эти электроны слабее всех связаны с ядром и называются валентными электронами. Слой, в котором находятся эти электроны, называется валентным слоем. Количество электронов в этом слое определяет валентность элемента и его способность соединяться с другими элементами.
Элементы, атомы которых имеют в валентном слое мало электронов (от 1 до 3), называются металлами и отличаются большой удельной электрической проводимостью. Это объясняется тем, что эти электроны в металле относительно свободны, не связаны ни с одним атомом жестко и могут свободно перемещаться между положительными ионами, образующими кристаллическую решётку металла. Под действием внешнего электрического поля движение электронов становится направленным и возникает электрический ток.
Элементы, у которых валентный слой полностью занят электронами, сильно связанными со своими атомами, являются диэлектриками.
Между этими двумя крайними случаями лежит ряд веществ, которые имеют промежуточные свойства. Большинство их являются полупроводниками.
Со структурой электронной оболочки атомов связаны и магнитные свойства тел. Материалы, у которых в электронной оболочке одинаковое количество электронов с положительными и отрицательными спинами ms , т. е. магнитные моменты которых скомпенсированы, являются диамагнетиками. Остальные материалы, у которых магнитные моменты не скомпенсированы, являются парамагнетиками. У некоторых из них в области температур ниже так называемой точки Кюри происходит под действием магнитного поля параллельная ориентация магнитных моментов. Такие материалы называются ферромагнетиками. В некоторых случаях при температуре ниже точки Кюри происходит антипараллельная ориентация магнитных моментов. Такие материалы называются антиферромагнетиками. При температуре выше точки Кюри как ферромагнитные, так и антиферромагнитные материалы ведут себя как парамагнитные. Для атомов ферромагнитных элементов типично то, что в их электронной оболочке имеется не полностью занятый внутренний слой, на котором имеются электроны с некомпенсированными спиновым магнитным моментом.
