
- •© Фгбоу впо «Тамбовский государственный технический университет» (тгту), 2012 Введение
- •2. Определение газовой постоянно r.
- •3. Проверка первого начала термодинамики.
- •Описание установки:
- •Порядок выполнения работы:
- •Обработка результатов измерений:
- •Контрольные вопросы:
- •Лабораторная работа № 2 Определение отношения Ср/Сv (для воздуха методом Клемана - Дезорма).
- •Технические характеристики
- •Устройство и принцип работы лабораторной установки
- •Краткая теория
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №3 «Определение отношения молярных теплоемкостей Ср/Сv методом измерения скорости звука»
- •Порядок выполнения работы.
- •Контрольные вопросы
- •Лабораторная работа № 4 Определение приращения энтропии при нагревании и плавлении олова.
- •Устройство и принцип работы лабораторной установки (рис.2.1)
- •Технические характеристики
- •Краткая теория.
- •Порядок выполнения работы
- •Устройство и принцип работы лабораторной установки (рис.1)
- •Теоретические основы работы:
- •Порядок выполнения работы:
- •Лабораторная работа №6 Экспериментальное определение коэффициента внутреннего трения воздуха.
- •Технические характеристики
- •Порядок выполнения работы:
- •Атомная, квантовая и ядерная физика Лабораторная работа №7 Определение постоянной в законе Стефана –Больцмана
- •Методические указания
- •Порядок проведения эксперимента.
- •Обработка результатов измерений
- •Задание 3.
- •Контрольные вопросы
- •Лабораторная работа №8 Изучение внешнего фотоэффекта.
- •Краткая теория
- •Описание установки
- •З адания
- •Контрольные вопросы
- •Лабораторная работа №9 Наблюдение спектра атомарного водорода и определение постоянной Ридберга.
- •Краткая теория.
- •Описание установки
- •Ход работы
- •Контрольные вопросы.
- •Лабораторная работа №10 опыт франка и герца
- •1 Введение
- •2 Схема опыта
- •3 Анодная и задерживающая характеристик
- •3.1 Анодная характеристика в вакууме
- •3.2 Анодная характеристика при наличии паров ртути
- •3.3 Характеристика задержки и функция распределения электронов по энергиям
- •4 Учебный лабораторный комплекс «Опыт Франка и Герца»
- •Приборная часть.
- •4.2 Компьютерно-програмная часть.
- •5 Эксперимент
- •Подготовительный этап.
- •Настройка и запись вольтамперных характеристик.
- •Исследование и печать вольтамперных характеристик.
- •5.4 Определение первого резонансного потенциала возбуждения атомов ртути и расчет длины волны соответствующего перехода.
- •Расчет вероятности упругого и неупругого взаимодействий электронов с атомами ртути.
- •Контрольные вопросы.
- •Изучение ядерных реакций
- •Общие сведения и методические указания
- •Порядок выполнения работы
- •Теория метода и описание установки.
- •Задание 1. Получение экспериментальных данных по температуре (т) и времени (t) охлаждения образца.
- •Задание 2. Нахождение производных в окрестностях температур.
- •Задание 3. Определение удельной теплоемкости железа и алюминия. Построение графика зависимости молярной теплоемкости от температуры.
- •Задание 4. Определение коэффициента теплоотдачи.
- •Описание установки
- •Порядок выполнения работы Задание 1
- •Задание 2
- •Лабораторная работа №14
- •Литература
Порядок выполнения работы
1. Перенесите рис. 1 на кальку, сохранив масштаб. Нарисуйте и совместите систему координат ОХY c «вилкой» треков частиц так, как показано на рис.2.
2. Измерьте углы транспортиром между осью оу и треками протона и дочернего ядра.
3. Измерьте длину трека протона и определите по графику (рис.3) значение его кинетической энергии.
4. Вычислите импульс протона по формуле (8.7).
5. Спроектировав
на ось оу
импульсы протона
![]() и
дочернего ядра
и
дочернего ядра
![]() ,
,
из равенства
проекций получим, что
![]()
Определите импульс
дочернего ядра как
![]()
6. Рассчитайте импульс частицы по формуле (2).
7. Значение рассчитанных импульсов и энергий всех частиц участвующих в реакции занесите в таблицу:
№ |
lp |
Tp |
Tα |
TX |
Pp |
Pα |
PX |
1 |
|
|
|
|
|
|
|
8. Записав закон сохранения энергии (5), рассчитайте значение энергии покоя дочернего ядра Еох и по формуле (6) определите массу покоя дочернего ядра (учитывая соотношение: 1 а.е.м.=931,5 Мэв ).
9. Вычислите энергетический эффект ядерной реакции по формуле (8).
Сделайте выводы.
Физика твердого тела
Лабораторная работа №12
Исследование теплоемкости твердых тел в интервале температур от 350 К до 900 К.
Цель работы: определить теплоемкость металлов и коэффициент теплоотдачи методом охлаждения, провести проверку выполняемости закона Дюлонга и Пти.
Приборы и принадлежности: набор образцов, электропечь, ЛАТР, термопара, потенциометр КСП-4 или милливольтметр градуированный по хромель-копелевой термопаре МПП-154М, секундомер.
Краткая теория.
Согласно классической
теории теплоемкости молярная теплоемкость
кристаллических тел при высоких
температурах одинакова и равна
![]() (закон Дюлонга и Пти). Этот закон может
быть выведен теоретически. В классической
теории теплоемкости кристалл
рассматривается как совокупность атомов
(молекул), совершающих колебания с одной
и той же частотой около положения
равновесия, совпадающего с узлами
кристаллической решетки. Каждый атом
обладает тремя колебательными степенями
свободы. По закону равномерного
распределения энергии по степеням
свободы на каждую степень свободы
приходится энергия
(закон Дюлонга и Пти). Этот закон может
быть выведен теоретически. В классической
теории теплоемкости кристалл
рассматривается как совокупность атомов
(молекул), совершающих колебания с одной
и той же частотой около положения
равновесия, совпадающего с узлами
кристаллической решетки. Каждый атом
обладает тремя колебательными степенями
свободы. По закону равномерного
распределения энергии по степеням
свободы на каждую степень свободы
приходится энергия
![]() ,
равная
,
равная
![]() ,
где k
– постоянная Больцмана. Полная энергия
колеблющейся частицы складывается из
периодически меняющихся потенциальной
Eп
и кинетической энергий Ек,
средние значения которых равны друг
другу <Ек>
= <Eп>.
Поскольку средняя энергия, приходящаяся
на одну колебательную степень свободы
колеблющейся частицы равна
,
где k
– постоянная Больцмана. Полная энергия
колеблющейся частицы складывается из
периодически меняющихся потенциальной
Eп
и кинетической энергий Ек,
средние значения которых равны друг
другу <Ек>
= <Eп>.
Поскольку средняя энергия, приходящаяся
на одну колебательную степень свободы
колеблющейся частицы равна
![]() .
На все три колебательные степени свободы
приходится энергия
.
На все три колебательные степени свободы
приходится энергия
![]() .
В одном моле содержится Na
атомов (Na
– число Авогадро), тогда внутренняя
энергия моля кристалла равна
.
В одном моле содержится Na
атомов (Na
– число Авогадро), тогда внутренняя
энергия моля кристалла равна
![]() ,
где
,
где
![]() ,
,
![]() - газовая постоянная.
- газовая постоянная.
Поскольку твердые тела обладают малым коэффициентом термического расширения, и, следовательно, мало увеличиваются в объеме при нагревании, для них часто не различают теплоемкость при постоянном объеме от теплоемкости при постоянном давлении, а говорят просто о теплоемкости твердого тела С, которая численно равна первой производной от внутренней энергии тела по температуре:
![]() (1)
(1)
Подставляя в выражение (1.1) для теплоемкости значение внутренней энергии твердого тела, найдем:
![]() . (2)
. (2)
Подставляя значение
газовой постоянной R,
получим
![]() 25
25![]() .
.
Таким образом, при достаточно высокой температуре атомная теплоемкость всех твердых тел слабо зависит от температуры и равна 3R.
Этот закон был открыт эмпирически еще в XIX веке Дюлонгом (1785-1838) и Пти (1791-1820) и носит их имя (закон Дюлонга и Пти). Величины, приведенные в таблице 1.1, убеждают в том, что во многих случаях закон Дюлонга и Пти удовлетворительно выполняется и, следовательно, для указанных в таблице веществ колебания атомов уже при комнатной температуре можно считать независимыми. В тоже время имеются такие вещества, как, например, алмаз или бор, для которых измеренное при комнатной температуре значение теплоемкости существенно отличается от 3R.
Для этих веществ, очевидно, комнатная температура, недостаточно высока для того, чтобы считать колебания атомов независимыми.
Таблица 1
вещество |
атомная теплоемкость |
алюминий железо медь кремний |
3,07 R 3,18 R 2,95 R 2,34 R |
Таблица 1.2
Молекулярная теплоемкость химических соединений в твердом состоянии
соединение |
молекулярная теплоемкость |
PbO AgCL BaCl2 |
5,78 R 6,29 R 9,3 R |
В случае твердых соединений, элементарная ячейка которых состоящих из двух атомов, например KCl, PbO и т.д., молекулярная теплоемкость согласно этому правилу должна равняться 6R, а для твердых соединений, с ячейкой из трех атомов, например CaCl2, PbCl2 и т.д., соответственно 9R. В таблице 1.2 приведены величины молекулярных теплоемкостей некоторых соединений, подтверждающие сформулированное правило.
Как показывает опыт, постоянство теплоемкости твердых тел нарушается при понижении температуры. Теплоемкости твердых тел уменьшаются при понижении температуры, стремясь к нулю при приближении температуры к абсолютному нулю. Вблизи абсолютного нуля молярная теплоемкость всех тел пропорциональна Т3.
Теория теплоемкости твердых тел была создана Эйнштейном и Дебаем. Она учитывает, что колебания частиц в кристаллической решетке не являются независимыми и что энергия колебательного движения квантованна.
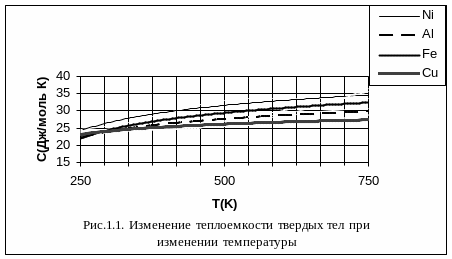
На рисунке 1.1 изображено определенное экспериментальное изменение теплоемкости твердого тела при изменении температуры. Как мы видим, при сравнительно высоких температурах теплоемкость твердого тела не зависит от температуры. Это область применения закона Дюлонга и Пти. При температурах, прилегающих к абсолютному нулю, наблюдается пропорциональность теплоемкости третьей степени температуры T0 – это область, в которой выполняется закон Дебая. Между ними лежит промежуточная область, для которой количественную связь между теплоемкостью и температурой пока установить не удалось.
