
- •Предисловие
- •Модуль курса общей химии «Учение о растворах. Протолитические и гетерогенные равновесия»
- •Темы занятий модуля Для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Для студентов фармацевтического факультета
- •Литература
- •Введение
- •Тема: Вода как универсальный биорастворитель. Коллигативные свойства растворов электролитов и неэлектролитов
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Свойства и функции воды
- •1) Растворение веществ с ионным типом связи
- •Гидратация ионов
- •Коллигативные свойства растворов
- •К коллигативным свойствам относятся:
- •Диффузия;
- •Диффузия
- •Осмос. Осмотическое давление
- •Изотонический раствор
- •Гипертонический раствор
- •Гипотонический раствор
- •При снижении осмотического давления крови до 400-350 кПа н аступает гибель организма.
- •Давление насыщенного пара растворителя над раствором
- •Повышение температуры кипения и понижение температуры кристаллизации раствора по сравнению с растворителем
- •Для растворов электролитов в математическое выражение II закона Рауля вводится изотонический коэффициент I:
- •Типовые упражнения и задачи с решениями
- •Переход от массовой доли к молярной концентрации осуществляется по формуле:
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •Учебно-исследовательская лабораторная работа Тема: Осмос Опыт №1: Наблюдение явлений плазмолиза и гемолиза
- •Тема: Протолитические процессы и равновесия. Водородный показатель. Колориметрическое определение рН
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Э лектролиты
- •Вывод закона разведения Оствальда:
- •Петер-Йозеф-Вильгельм Дебай (24.03.1884-2.11.1966).
- •Биологическая роль электролитов в организме
- •Средние ежедневные поступления и потери жидкости у взрослых
- •Причины нарушения водного обмена
- •Баланс электролитов в организме
- •Водно-электролитный баланс биологических жидкостей в организме человека
- •Ионное произведение воды. Водородный и гидроксильный показатели
- •Характеристика среды раствора
- •Диапазон изменения рН биологических жидкостей
- •Интервал рН перехода окраски индикаторов
- •Типовые упражнения и задачи с решениями
- •Ответ: степень ионизации гликолевой кислоты 5,44×10–2.
- •Ответ: общая кислотность уксусной кислоты 1,75×10–5 моль/л.
- •Обучающие тесты
- •У чебно-исследовательская лабораторная работа Тема: Определение рН растворов
- •Опыт № 1. Определение рН биологической жидкости с помощью универсального индикатора
- •Опыт № 2. Одноцветные и двуцветные индикаторы
- •Опыт № 3. Смещение равновесия диссоциации уксусной кислоты и гидроксида аммония
- •Тема: Протолитические процессы и равновесия. Теории кислот и оснований. Гидролиз
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типы протолитических реакций
- •Электронная теория Льюиса
- •Жесткие, мягкие кислоты и основания (жмко)
- •Типовые упражнения и задачи с решениями
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гидролиз солей
- •Тема: Протолитические процессы и равновесия. Буферные растворы
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типовые упражнения и задачи с решениями
- •Учебно-исследовательская лабораторная работа Тема: Буферные системы. Буферные системы организма
- •Опыт 2.1. Определение способности буферных растворов сохранять рН при добавлении щелочей
- •Опыт 2.2. Определение способности буферных растворов сохранять рН при добавлении кислот
- •Опыт 2.3. Определение способности буферных растворов сохранять рН при разбавлении
- •Тема: Протолитические процессы и равновесия. Буферные системы организма
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Гидрокарбонатная буферная система
- •Гидрофосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •Бикарбонатной буферных систем
- •Диапазон изменения значений рН при различных типах нарушения кислотно-основного баланса в организме
- •Причины и классификация ацидоза и алкалоза
- •Основные показатели крови при нарушении кислотно-основного баланса
- •Типовые упражнения и задачи с решениями
- •Обучающие тесты
- •Учебно-исследовательская лабораторная работа Тема: Определение буферной емкости сыворотки крови
- •Тема: Гетерогенные процессы и равновесия
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Взаимосвязь Ks и растворимости s:
- •Конкурирующие гетерогенные процессы: конкуренция за катион или анион
- •Формирование костной ткани
- •Патологические гетерогенные процессы в организме
- •Т иповые упражнения и задачи с решениями
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гетерогенные равновесия
- •Опыт № 1. Условия образования осадка
- •Опыт № 2. Влияние одноименного иона на образование осадка
- •Опыт № 3. Влияние константы растворимости электролитов на их способность к переосаждению
- •Опыт № 4. Условия растворения осадка
- •Теоретические вопросы к контрольной работе по модулю для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического и медико-профилактического факультетов
- •Экзаменационные теоретические вопросы для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Приложение
- •1. Константы некоторых жидкостей, применяемых в качестве растворителей
- •2. Коэффициенты активности f ионов в водных растворах
- •3. Средние значения водородного показателя (рН) биологических жидкостей
- •4. Ионное произведение воды kw при различных температурах
- •5. Силовые показатели и константы ионизации кислот по реакции
- •6. Константы растворимости некоторых малорастворимых солей и гидроксидов (25оС)
- •7. Константы нестойкости комплексных ионов в водных растворах (25оС)
- •8. Измененения содержания воды в организме в зависимости от возраста
- •9. Распределение воды в организме в зависимости от пола
- •10. Основные элементы жидкостных компартментов организма
- •11. Вещества определяющие осмоляльность плазмы
- •12. Наиболее часто используемые кристаллоидные растворы
- •Оглавление
Тема: Протолитические процессы и равновесия. Буферные растворы
Цели изучения: сформировать знания о механизме действия буферных систем, их роли в поддержании кислотно-основного баланса, сформировать ценностное отношение к полученным знаниям для медицинского образования; научиться производить расчеты рН буферных систем; экспериментально определять буферную емкость, готовить буферные растворы; продолжить формирование умений работать с учебной и справочной литературой.
Учебно-целевые вопросы
Состав и классификация буферных систем.
Механизм действия буферных систем по отношению к кислотам и щелочам.
Вывод уравнения Гендерсона–Гассельбаха для расчета значений рН буферных растворов. Факторы, влияющие на значение рН буферных систем.
Количественная характеристика (буферная емкость) буферных систем. Факторы, влияющие на величину буферной емкости.
Краткая теоретическая часть
Б уферный
раствор –
это раствор, содержащий протолитическую
равновесную систему, способную
поддерживать практически постоянное
значение рН при разбавлении или при
добавлении небольших количеств кислоты
или щелочи.
уферный
раствор –
это раствор, содержащий протолитическую
равновесную систему, способную
поддерживать практически постоянное
значение рН при разбавлении или при
добавлении небольших количеств кислоты
или щелочи.
В протолитических буферных растворах компонентами являются донор и акцептор протонов, представляющие собой сопряжённую кислотно-основную пару. В качестве донора протона выступает слабая кислота или сопряжённая кислота слабого основания. Акцептором протона является анион слабой кислоты или слабое основание. По принадлежности слабого электролита к классу кислот или оснований буферные системы подразделяют на кислотные и основные.
К ислотные буферные системы – это растворы, содержащие слабую кислоту (донор протонов) и сопряженное основание (акцептор про
тонов).
системы Состав |
Ацетатная |
Гидрокарбонатная |
Гидрофосфатная |
Кислота |
СН3СООН |
Н2СО3 |
Н2РО |
Сопряженное основание |
СН3СОО– |
НСО |
НРО |
О сновные
буферные системы
– это растворы, содержащие слабое
основание (акцептор протонов) и сопряженную
кислоту (донор протонов).
сновные
буферные системы
– это растворы, содержащие слабое
основание (акцептор протонов) и сопряженную
кислоту (донор протонов).
Название буферной системы |
Основание |
Сопряженная кислота |
Аммиачная |
NH3H2O |
NH |
М еханизм
буферного действия
– это протолитическое взаимодействие
кислоты и основания с добавляемыми
ионами Н+
и ОН–.
еханизм
буферного действия
– это протолитическое взаимодействие
кислоты и основания с добавляемыми
ионами Н+
и ОН–.
Название буферной системы |
Основание + Н+ |
Кислота + ОН– |
Ацетатная |
СН3СОО– +Н+ ((;(( СН3СООН |
СН3СООН+ОН–((;((СН3СОО–+Н2О |
Гидрокарбонатная |
НСО +Н+ ((;(( Н2СО3 |
Н2СО3 + ОН– ((;(( НСО +Н2О |
Фосфатная |
НРО |
Н2РО + ОН– ((;(( НРО + Н2О |
Аммиачная |
NH3H2O + H+ ((;(( NH + H2O |
NH + OH– ((;(( NH3H2O |
Добавляемые к буферным растворам протоны связываются основаниями в слабые кислоты (сильная кислота замещается эквивалентным количеством слабой кислоты). Диссоциация слабой кислоты подавляется вследствие увеличения ее концентрации (закон разведения Оствальда) и рН практически не меняется.
Добавляемые анионы гидроксила взаимодействуют со слабой кислотой буферной системы, концентрация ее при этом уменьшается, а по закону Оствальда степень диссоциации увеличивается и концентрация ионов водорода восполняется. Образующаяся соль практически не влияет на значение рН.
Защитное действие буферных систем будет сохраняться до тех пор, пока концентрации компонентов буферных систем будут больше концентрации добавляемых ионов. Достаточное буферное действие наблюдается в том случае, если соотношение концентраций компонентов не превышает 10, то есть
![]() а рН = рKa
1.
а рН = рKa
1.
Таким образом, буферные растворы поддерживают значение рН в диапазоне от рН = рKa –1 до рН = рKa + 1
При разбавлении концентрации компонентов буферного раствора изменяются в равной степени, поэтому соотношение их концентраций, а, следовательно, и значение рН остаются практически неизменными.
Уравнение
Гендерсона-Гассельбаха
– это уравнение для расчета рН буферных
растворов. Приведем вывод этого уравнения
на примере аммиачного буферного раствора,
состоящего из основания NH3H2O
и сопряженной кислоты NH![]() .
.
NH + Н2О ((;(( NH3H2O + Н+
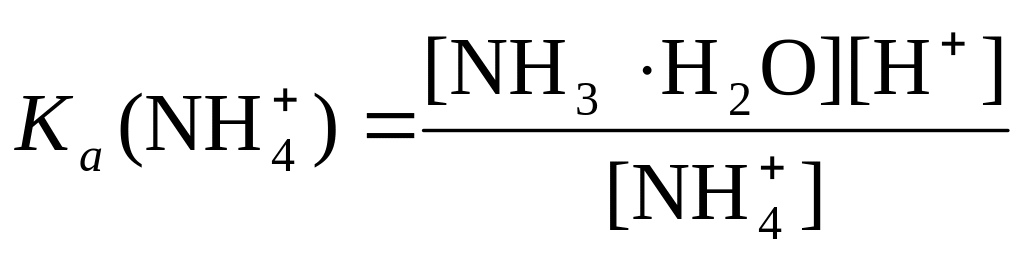 ,
отсюда
,
отсюда
![]()
![]()
В общем виде уравнение можно записать следующим образом
рН
= рKа(ВН+)
–
![]() или
или
рН
= 14 – рKв +
![]()
Кислотные буферные системы |
Основные буферные системы |
рН = рKа
–
рН
= рKа
+
|
рН = 14 – рKв+
рН
= 14 – рKв
– |
Для количественной характеристики возможности буферных систем сопротивляться изменению рН при добавлении кислот и оснований используется понятие буферной ёмкости.
Б уферная
емкость (В)
– количество вещества эквивалента
кислоты или щелочи, которое нужно
добавить к 1 литру буферного раствора,
чтобы изменить величину рН на единицу.
уферная
емкость (В)
– количество вещества эквивалента
кислоты или щелочи, которое нужно
добавить к 1 литру буферного раствора,
чтобы изменить величину рН на единицу.
Буферная емкость по кислоте (моль/л) |
Буферная емкость по основанию (моль/л) |
Ва
=
|
Вв
=
|
Буферная емкость зависит от концентраций компонентов в буферном растворе и их соотношения. Чем выше концентрация компонентов, тем большее количество приливаемых кислот и оснований может быть ими связано. Буферная ёмкость достигает максимального значения при равенстве концентраций компонентов, причём в этом случае Ва = Вв, а рН = рKа.
![]() ,
при [соль] = [кислота] lg
1 = 0, а рН = pKa.
,
при [соль] = [кислота] lg
1 = 0, а рН = pKa.

 Название
буферной
Название
буферной