
- •«Метрологія, технологічні вимірювання та прилади»
- •Модуль 2: Вимірювання переміщень, зусиль, швидкості, тиску й температури.
- •Вивчення індукційних первинних вимірювальних перетворювачів переміщення
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •6.1 Дослідження диференційно - трансформаторного пп
- •6.2 Дослідження індуктивного пп2 з мостовою схемою включення обмоток
- •7. Обробка результатів дослідів
- •8. Оформлення протоколу
- •Вивчення оптичних первинних вимірювальних перетворювачів переміщення
- •При виконанні лабораторної роботи студент повинен:
- •Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •6.1 Перевірка працездатності систем обліку одиничної продукції
- •Перевірка працездатності системи контролю швидкості обертання вала
- •7. Обробка результатів дослідів
- •8. Оформлення протоколу
- •Вивчення тензометричного пп переміщення
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •7. Обробка результатів дослідів
- •8. Оформлення протоколу
- •Вивчення технічних манометрів
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •6.1 Перевірка працездатності показуючого манометра дм10010у2
- •6.2.Перевірка працездатності контактного манометра дм2010СгУ2
- •6.3 Перевірка працездатності безшкального манометра пмп-10м
- •7. Обробка результатів дослідів
- •7.1 Перевірка манометра дм 10010у2
- •7.2 Перевірка контактного манометра дм2010 СгУ2
- •7.3 Перевірка бесшкального манометра пмп-10м
- •8. Оформлення звіту
- •Вивчення диференційно – трансформаторної
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні запитання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •7. Обробка результатів дослідів
- •8. Оформлення звіту
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні запитання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •7. Обробка результатів дослідів
- •8. Оформлення звіту
- •Вивчення дилатометричного датчика-реле тудэ-1 і манометричного термометра тпп-ск
- •При виконанні лабораторної роботи студент повинен:
- •Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •6.1 Перевірка працездатності ділатометричного термометра
- •6.2 Перевірки працездатності манометричного термометра
- •7. Обробка результатів дослідів
- •7.1 Перевірка працездатності дилатометричного термометра
- •7.2 Перевірка працездатності манометричного термометра
- •8. Оформлення протоколу
- •Вивчення термоелектричного термометра
- •При виконанні лабораторної роботи студент повинен:
- •Загальні положення
- •6.2 Підготовка ксп-4 для реєстрації графіка перехідної характеристики досліджуваного пп
- •6.3 Перевірка коефіцієнта теплової інерції термопари.
- •Обробка результатів дослідів
- •Експериментальна нсх термоелектричного термометра
- •7.2 Показник теплової інерції термопари
- •Оформлення протоколу
- •Вивчення термометра опору
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •Лабораторний стенд (рис. 18) описаний у п.5 лабораторної роботи №7.
- •6.2 Підготовка ксм-4 для реєстрації графіка перехідної характеристики досліджуваного пп
- •6.3 Перевірка коефіцієнта теплової інерції досліджуваного пп
- •7. Обробка результатів дослідів
- •7.1 Експериментальна нсх термометра опору
- •7.2 Показник теплової інерції термометра опору
- •8. Оформлення протоколу
- •Вивчення пп температури з уніфікованим вихідним сигналом
- •При виконанні лабораторної роботи студент повинен:
- •Загальні положення
- •7. Обробка результатів дослідів
- •7.1 Експериментальна нсх пп температури типу дт-150
- •Пульсації вихідного струму пп температури типу дт-150
- •7.3 Показники теплової інерції пп температури типу дт-150
- •Оформлення протоколу
- •Вивчення логометра типу ш69000
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5.Опис лабораторного стенда
- •6. Порядок виконання роботи
- •Вивчення пірометричного мілівольтметра типу ш4500
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •Мілівольтметра мілівольтметра типу ш69003
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •7. Обробка результатів дослідів
- •8. Оформлення протоколу
- •Вивчення нормуючого перетворювача типу ш-79
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •6.1. Перевірка нсх нормуючого перетворювача ш-79
- •Вивчення автоматичного компенсаційного моста
- •При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •Вивчення автоматичного компенсаційного потенціометра
- •При виконанні лабораторної роботи студент повинен:
- •Загальні положення
- •Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •6.1 Перевірка й усунення типових несправностей потенціометра
- •6.2 Перевірка показуючого пристрою автоматичного потенціометра
- •Вивчення автоматичних реєструючих приладів серій рп160 і Диск-250
- •При виконанні лабораторної роботи студент повинен:
- •Загальні положення
- •Контрольні питання
- •6.4 Перевірка вихідних пристроїв рп160-13 (Диск-250)
- •7.4 Перевірки реєструючого пристрою і спм рп160 (Диск-250)
- •8. Оформлення протоколу
- •Модуль 3: Вимірювання рівня, витрати й складу
- •Вивчення первинних вимірювальних перетворювачів рівня
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •8. Оформлення протоколу
- •Вивчення вимірювальних перетворювачів витрати (методи змінного й постійного перепаду тиску)
- •При виконанні лабораторної роботи студент повинен:
- •Загальні положення
- •Контрольні питання
- •Опис лабораторного стенда
- •Порядок виконання роботи
- •6.1 Тумблером 24 включіть стенд, потім тумблерами 25, 26 і 28 включіть, відповідно, вимірювальні комплекти va2304, рэ - ксд3 і насос.
- •Змінюючи витрати робочого середовища при прямому й зворотному ході встановіть стрілку ксд3 на кожну з оцифрованих рисок його шкали, зафіксувавши при цьому показання табло мар.
- •Оформлення звіту
- •Вивчення індукційного, ультразвукового і тахометрического витратомірів
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •Витратомір ultraflow II (рис. 44) містить два ультразвукові перетво-
- •У корпусі 1 безшкального одноструменевого перетворювача (рис. 45) з
- •Активним імульсним виходом фірми Kamstrap обертається крильчатка 2, швидкість якої пропорційна витраті рідини. Корпус крильчатки виготовлений з
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •6.1 Перевірка ультразвукового витратоміра ultraflow II
- •Вивчення індукційного концентратоміра типу кнц-1м-6у3
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •7. Обробка результатів дослідів
- •8. Оформлення протоколу
- •Вивчення комплекту промислового рН-метра типу рН-261 і його елементів
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •6.1. Дослідження електродної системи рН - метра
- •6.2. Перевірка працездатності вторинного приладу типу рН-261.
- •6.3 Вивчення системи вимірювання рН
- •7. Обробка результатів дослідів
- •8. Оформлення звіту
- •Вивчення гігрометра типу гп-225-212
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання
- •6.1 Настроювання гігрометра гп-225-212
- •6.2 Перевірка гігрометра гп-225-212
- •Температура Відносна вологість повітря Опір, аналізованого м, %
- •7. Обробка результатів дослідів
- •8. Оформлення звіту
- •Вивчення тепломіра типу multical III
- •При виконанні лабораторної роботи студент повинен:
- •Загальні положення
- •Подача гарячого теплоносія
- •6.2 Перевірка обчислювача по каналу кількості теплоти
- •7. Обробка результатів дослідів
- •8. Оформлення звіту
- •Вивчення вимірювально-інформаційної системи (віс) на основі мікропроцесорного вимірника типу укт-38 «овен»
- •2. При виконанні лабораторної роботи студент повинен:
- •3. Загальні положення
- •4. Контрольні питання
- •5. Опис лабораторного стенда
- •6. Порядок виконання роботи
- •6.1 Дослідження мікроконтролера типу укт-38
- •6.2 Дослідження інформаційно-вимірювальної системи
- •7. Обробка результатів дослідів
- •8. Оформлення протоколу
- •Використана література
- •Додатки
- •А1. Номінальні статичні характеристики термометрів опору
- •А2. Номінальні статичні характеристики термоелектричних термометрів (в діапазоні температур 0 t 100 0с)
- •Термопара тхк, град. Хк
- •А 3. Номінальна статична характеристика електродної системи
8. Оформлення протоколу
8.1 На титульній стороні подвійного аркуша вкажіть П. І. Б. студента, групу, найменування лабораторної роботи й дату її виконання.
8.2 Коротко опишіть стенд, мету і порядок виконання роботи.
8.3 Наведіть результати спостережень, розрахунків:таблиці, формули і висновки.
Л а б о р а т о р н а р о б о т а № 21
Вивчення комплекту промислового рН-метра типу рН-261 і його елементів
1. Мета роботи - вивчення чутливого елемента (електродної системи) рН-метра й перевірка працездатності комплекту промислового рН-метра.
2. При виконанні лабораторної роботи студент повинен:
Знати: мету і зміст майбутньої роботи, порядок її виконання й основні теоретичні положення даної теми.
Вміти: користуватися вимірювальними приладами лабораторного стенда.
3. Загальні положення
Автоматичні потенциометричні аналізатори (рН-метри й рХ-метри) застосовуються в системах безперервного технологічного контролю й регулювання кислотності, лужності; окисно-відновлювального потенціалу й ін. параметрів фізико-хімічних, біохімічних, і хімічних процесів, які характеризуються рівнем активності іонів водню, натрію, хрому та інших речовин у розчинах.
Принцип дії аналізаторів заснований на законі Нернста (21.1), що зв'язує величину потенціалу Е, що виникає на поверхні електрода з металу (або його важкорозчинної солі), при його зануренні в розчин, де є іони цього металу (солі) з активною концентрацією аi:
![]() (21.1)
(21.1)
$ > де Е0 - нормальний потенціал металу (при одиничній концентрації його іонів у розчині, рівної 1 грам-еквівалент (моль) на 1 літр; R, Т - газова постійна й абсолютна температура; n, Р - валентність іонів і число Фарадея.
Кислотність (лужність) розчинів характеризується значенням негативного логарифма активності іонів аН водню, що позначається рН (водневий показник):
рН = - Lg аН (21.2)
Для нейтральних розчинів рН=7, кислі розчини мають рН<7, лужні рН>7.
На величину рН впливає температура. Дистильована вода, наприклад, при температурі 22 0С нейтральна, має рН=7, однак при нагріванні до 100 0С вона здобуває кислі властивості: рН=6,12. При нульовій температурі вода має лужні властивості: рН=7,97. Тому промислові рН-метри мають температурний коректор результату вимірювання.
Більшість потенціометричних аналізаторів вимірюють е.р.с., що розвивається чутливим елементом, який представляє собою електродну систему, до складу якої входять вимірювальний і допоміжний електроди (рис.49).
У рХ-метрах визначення концентрації аніонів і катіонів Nа+, K+, Ca+, Hb-, Cl-, Br-, I- та інших, а також окисно-відновного потенціалу здійснюється іоноселективними електродами.
Мілівольтметр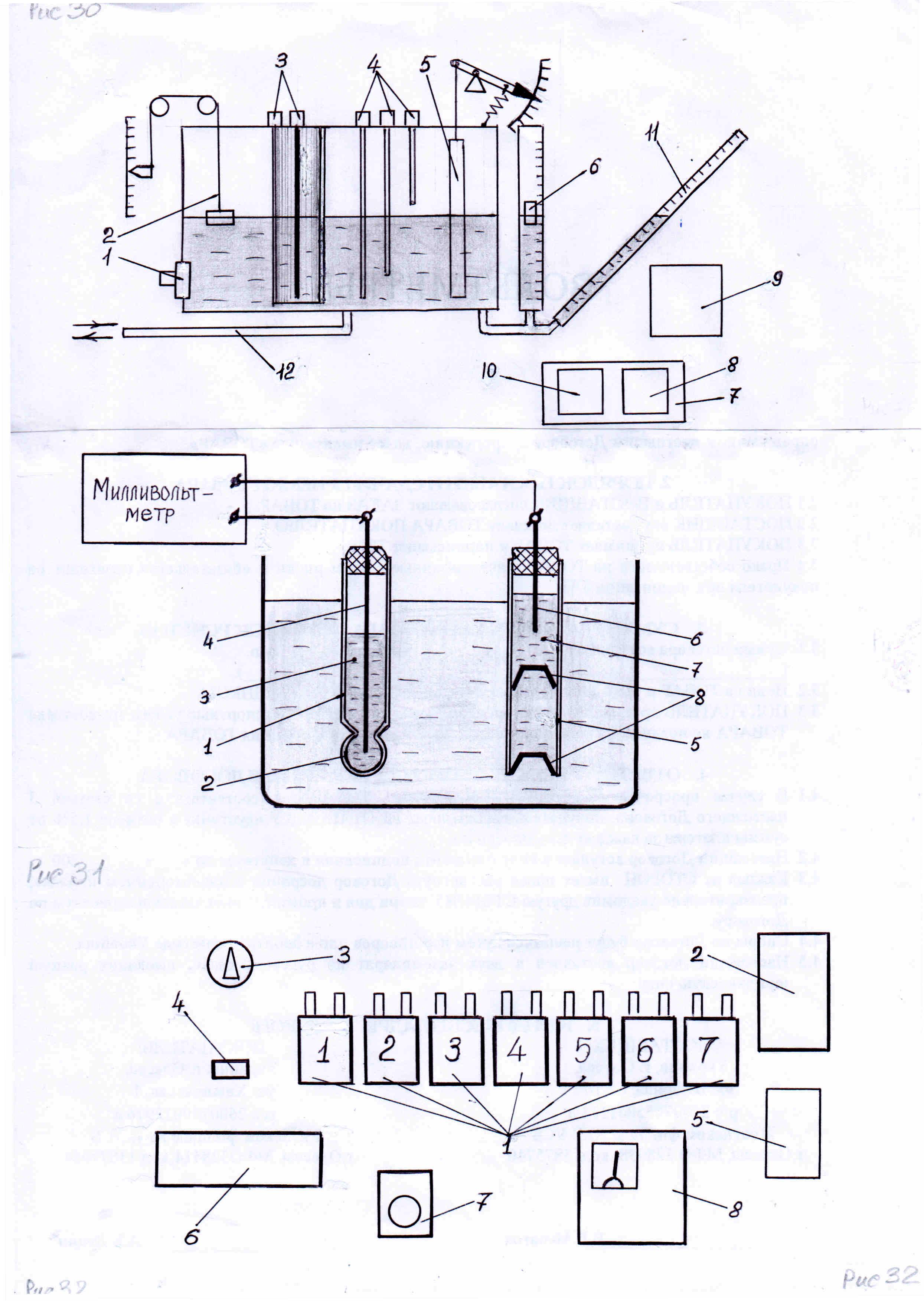
Рис. 49 - Чутливий елемент (електродна система) рН-метра
У рН-метрах водневий показник визначається скляними вимірювальними електродами, що перетворюють рівень активності іонів водню Н+ (величину рН) у значення електрорушійної сили.
Скляний електрод, показаний на рис. 49, виконано зі скляної трубки 1, до кінця якої припаяна тонкостінна мембрана 2 з літієвого скла у вигляді кульки. На зовнішній поверхні мембрани при її зануренні у розчин розвивається потенціал ЕН, що залежить від активної концентрації іонів водню Н+. Скляний електрод заповнений розчином 3 соляної кислоти НСL постійної концентрації, який замикає електричне коло між мембраною й платиновим контактним електродом 4, з'єднаним з вивідним проведенням.
Допоміжні електроди, призначені для створення опорного потенціалу (порівняння), бувають звичайно двох типів: виносними проточними або зануреними непроточними.
Допоміжний хлор-срібний електрод непроточного типу, показаний на рис.49, складається з товстостінної трубки 5, усередині якої знаходиться срібний контакт 6, занурений у насичений розчин 7 суміші хлористого калію KCL і кристалів хлористого срібла AgCL. Від аналізованого розчину внутрішня поверхня електрода 6 ізольована гумовими мембранами 8, між якими знаходиться розчин KCL. Електричне коло між контактом 6 і аналізованим розчином здійснюється по поверхні трубки 5 у місцях прилягання мембран 8.
Для перевірки чутливих елементів рН-метрів застосовують буферні розчини, які готовлять шляхом розчинення еталонів (стандартних зразків) складу солей, які називаються стандарт-титрами, у дистильованій воді. Кожний буферний розчин, отриманий таким чином, є робочим еталоном певного значення рН, а набір буферних розчинів дозволяє протестувати рН-метр у ряді точок його діапазону вимірювання.
