
- •Фазовое равновесие.
- •Условия равновесия фаз
- •Правила фаз Гиббса
- •Однокомпонентные системы.
- •Фазовая диаграмма однокомпонентной системы.
- •Равновесие чистого вещества в двух фазах однокомпонентной системы. Уравнение Клапейрона - Клаузиуса
- •Двухкомпонентные системы (растворы)
- •Коллигативные свойства предельно разбавленных растворов.
- •2. Повышение температуры кипения растворителя над раствором
- •3. Понижение температуры замерзания растворителя над раствором
- •4. Осмос
- •Концентрированные идеальные растворы
- •Состав пара над идеальным раствором
- •Построение диаграммы температура-состав. Законы Коновалова
- •Неидеальные растворы
- •Состав пара над неидеальным раствором.
Концентрированные идеальные растворы
Такие растворы существуют в действительности, это смеси изотопов, изомеров, ближних гомологов (бензол, толуол).
В них силы взаимодействия между молекулами чистых веществ и в растворе одинаковы.
![]()
Образование раствора происходит без выделения или поглощения тепла (H = 0) и изменения объема (V = 0). В идеальном растворе закон Рауля справедлив для обоих компонентов : PA = NAPA0, PB = NBPB0 – парциальное давление пара компонента над раствором пропорционально его мольной доле в растворе.
PA0 и PB0 – давление насыщенного пара чистых компонентов А и В.
Примечание: Идеальный раствор - это раствор, где закон Рауля справедлив для обоих компонентов во всей области концентраций и температур.

![]()
![]()
Состав пара над идеальным раствором
может быть рассчитан теоретически. Например, система бензол (Б) – толуол (Т), t = 60С
При Т = const (t = 60С)
PБ0 = 385 мм.рт.ст.
PТ0 = 140 мм.рт.ст.
t = 60С
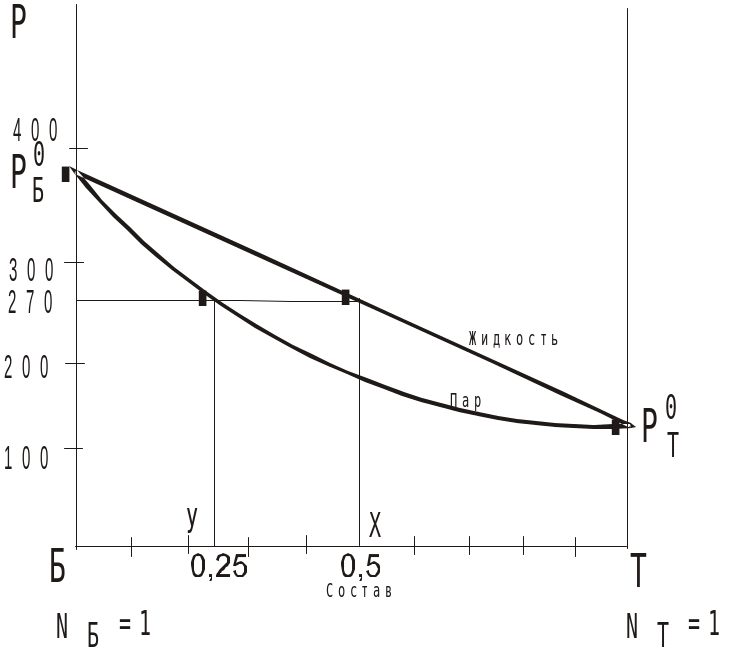
На диаграммах такого типа бывшая кривая общего давления называется кривой жидкости.
Состав пара считается по следствию закона Дальтона
Pi = Ni'Pобщ
Ni' – мольная доля компонента в паре
Парциальное давление компонентов для кривой жидкости рассчитывается по закону Рауля: Pi = NiPi0
Например: компонентов в жидкости поровну (т.е. NБ = 0,5 и NТ = 0,5)
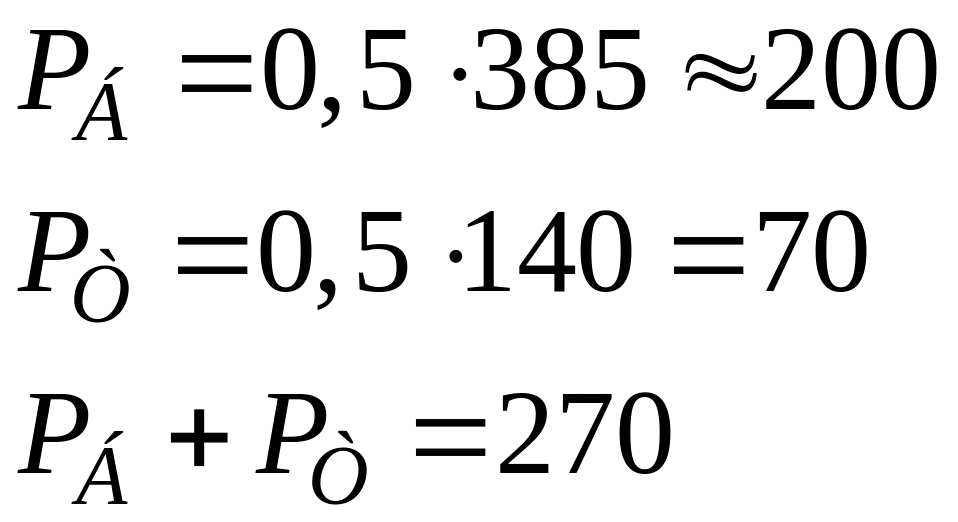
Pобщ = 270 мм.рт.ст.
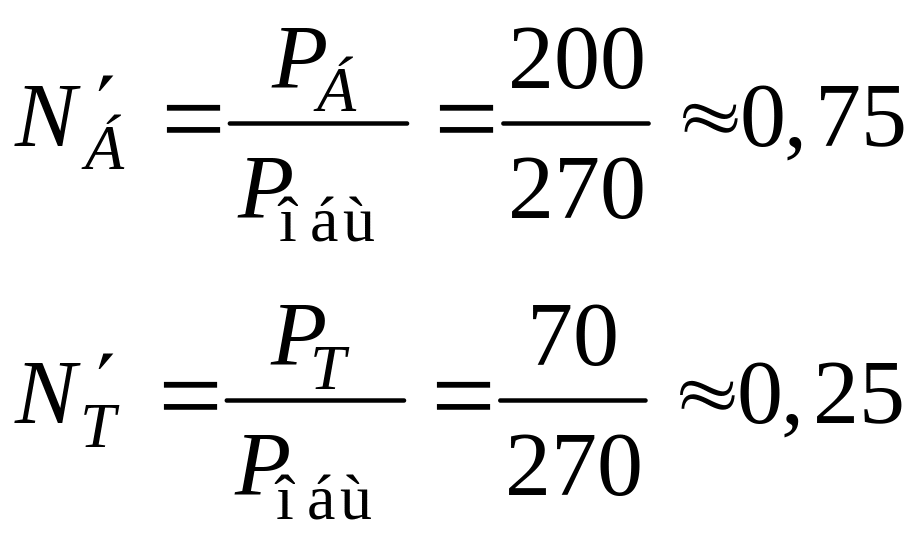
Построение диаграммы температура-состав. Законы Коновалова
Для этой же системы (бензол – толуол)
t, С
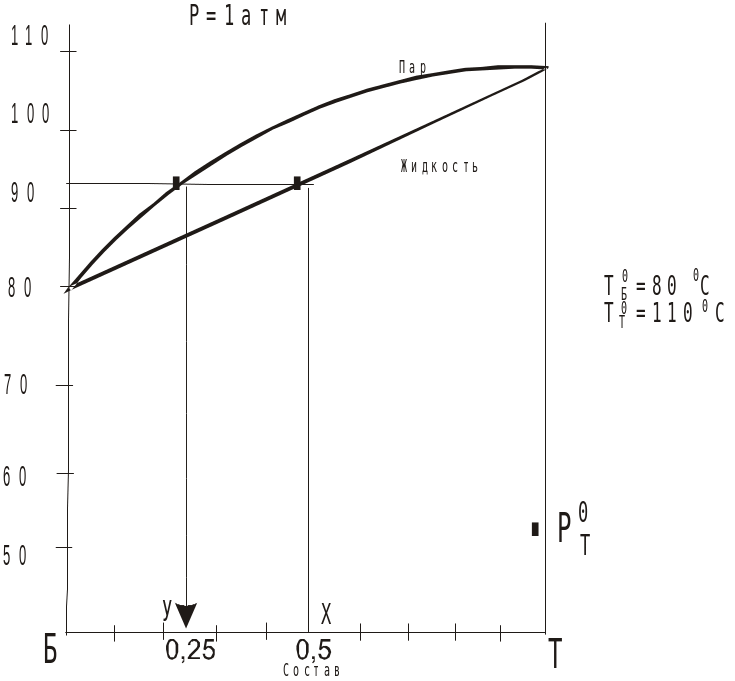
Вывод, который справедлив для любой системы, идеальной или неидеальной: в общем случае жидкость и пар имеют различный состав, при этом в паре больше того компонента, который более летуч (для данного примера более летуч – бензол, т.к. при Т = const у него больше давление насыщения пара, а при Р = const ниже температура кипения). Это первый закон Коновалова.
Составы слоев определяются точками пересечения соответствующей изотермы (ноды) с кривой
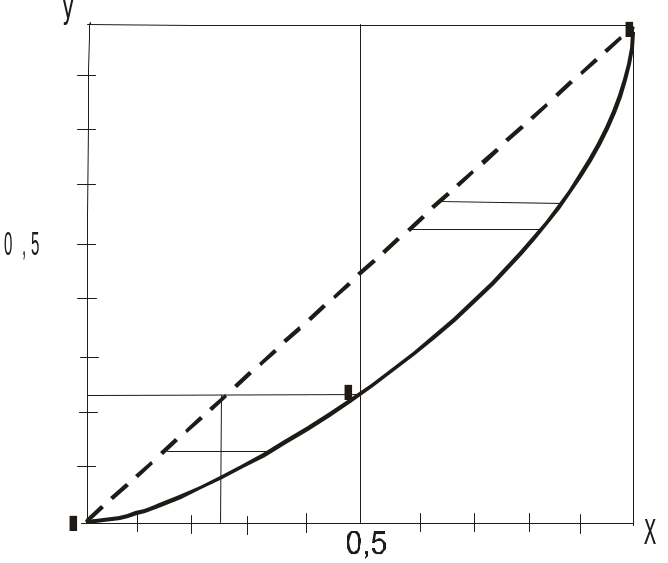
На практике для расчета числа теоретических тарелок ректификационной колонны используют, так называемые X–Y диаграммы.
Обозначим мольную долю компонента в жидкости через Х, а пара - через Y.
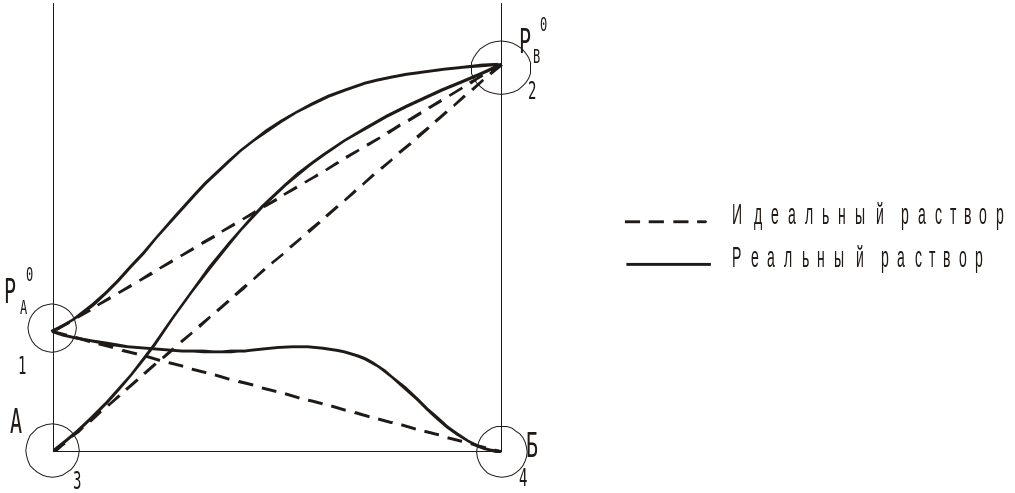
Неидеальные растворы
1. Система, где
взаимодействие между молекулами в
растворе меньше, чем в индивидуальном
состоянии
![]() наблюдаются положительные отклонения
от закона Рауля. Образование такого
раствора сопровождается поглощением
тепла
наблюдаются положительные отклонения
от закона Рауля. Образование такого
раствора сопровождается поглощением
тепла
![]() и
увеличением объема
и
увеличением объема
![]() .
.
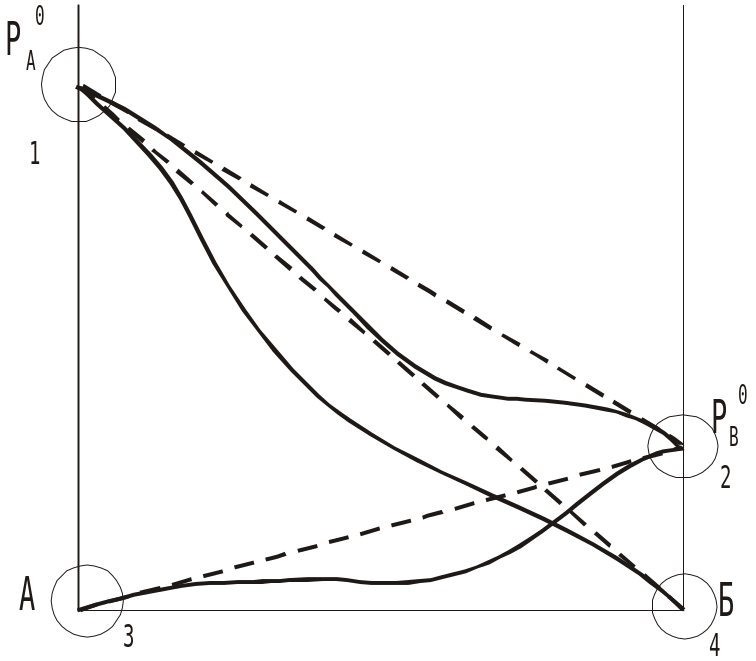
2. Если силы
взаимодействия между молекулами в
растворе больше, чем у индивидуальных
компонентов, отклонение от закона Рауля
будет отрицательным. Образование
раствора протекает с выделением тепла
и уменьшением объема.
![]() ,
,
![]() ,
,
![]() .
.
На диаграммах кружками обозначены области, в которых возможно применение законов Рауля и Генри:
1 и 2 – области применения закона Рауля для компонентов А и В.
3 – область применения закона Генри для компонента Б,
4 – область применения закона Генри для компонента А.
В растворах, где давление насыщенности паров компонентов (и Ткип) близки, но компоненты сильно отличаются по химической природе, отклонения от закона Рауля будет сильными. Поэтому на кривых общего давления возникают экстремальные точки – верхние при положительных отклонениях и нижние при отрицательных.
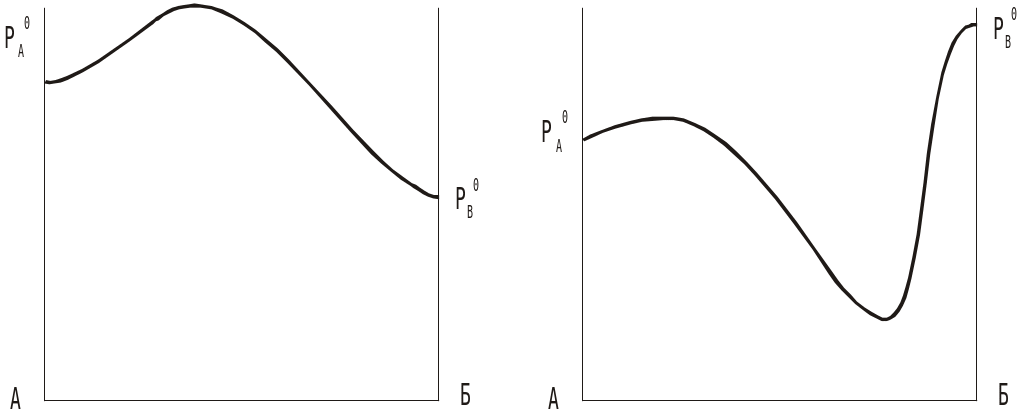
Эти точки, независимо от знака отклонения, называются азеотропными.
