
- •Фазовое равновесие.
- •Условия равновесия фаз
- •Правила фаз Гиббса
- •Однокомпонентные системы.
- •Фазовая диаграмма однокомпонентной системы.
- •Равновесие чистого вещества в двух фазах однокомпонентной системы. Уравнение Клапейрона - Клаузиуса
- •Двухкомпонентные системы (растворы)
- •Коллигативные свойства предельно разбавленных растворов.
- •2. Повышение температуры кипения растворителя над раствором
- •3. Понижение температуры замерзания растворителя над раствором
- •4. Осмос
- •Концентрированные идеальные растворы
- •Состав пара над идеальным раствором
- •Построение диаграммы температура-состав. Законы Коновалова
- •Неидеальные растворы
- •Состав пара над неидеальным раствором.
Фазовое равновесие.
Фазовыми называются термодинамические равновесия в гетерогенных системах, в которых не происходит химического взаимодействия компонентов, а имеют место лишь процессы перехода компонента из одной фазы в другую.
Термодинамические системы по фазовому составу подразделяются на:
1) однородные или гомогенные, внутри которых нет поверхности раздела
2) разнородные или гетерогенные, где различные по составу части системы отдельны друг от друга поверхностью раздела
Фаза-однородная часть гетерогенной системы, одинаковая по физико-химическому составу и отделенная от других частей системы поверхностью раздела.
Составляющее вещество-любое вещество, которое может быть выделено из системы и существовать вне нее.
Компонент - наименьшее число составляющих веществ, достаточное для образования всех фаз данной системы. В отсутствии химического взаимодействия число компонентов = числу составляющих веществ.
При химическом взаимодействии число компонентов рассчитывается как число составляющих веществ минус число уравнений связывающих концентрации этих веществ.
К=составляющие вещества - уравнения
![]()
К=3 – 1 = 2
![]()
![]()
К=3 – 2 = 1
![]()
![]()
Число степеней свободы - это число независимых переменных (в основном Р и Т), которые можно менять в небольших пределах без нарушения числа фаз системы, находящихся в равновесии.
Условия равновесия фаз
Поскольку перенос компонента из одной фазы в другую может осуществляться только в открытых системах, то будет справедливо выражение:
![]()
Рассмотрим двухфазовую систему, где происходит перенос компонента из фазы 1 в фазу 2:
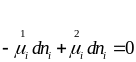
Перед химическим потенциалом 1 фазы ставим “ - ”, т.к. количество компонентов в ней убывает.
![]()
![]()
Этот вывод можно рассматривать на любое количество фаз.
![]()
т.е. условием равновесия фаз является равенство химических потенциалов данного компонента во всех фазах системы.
Вывод: самопроизвольный процесс в открытых системах протекает из фазы с большим химическим потенциалом, в фазу с меньшим химическим потенциалом до тех пор, пока значения потенциалов не сравняются, т.е. наступит состояние равновесия.
Правила фаз Гиббса
Выводится из условия равновесия фаз.
Правило фаз Гиббса: Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов действуют только Р и T, равно числу компонентов плюс два минус число фаз
С=К+2-Ф
где С- число степеней свободы
К- число компонентов
Ф- общее число фаз, находящихся в равновесии
“2”- число внешних независимых переменных (Р и Т), которые могут
повлиять на систему.
Если Р=const или T=const, то число переменных заменяется на “1”, т.е. С=К+1-Ф
Однокомпонентные системы.
Для них т.к. К=1: С=3-Ф. По физическому смыслу число степеней свободы не может быть отрицательным, а число фаз может меняться от 1 до 3 и число степеней свободы от 2 до 0.
“2”- Р и Т можно менять
“0”- ничего трогать нельзя
Равновесие в однокомпонентной системе может быть реализовано 3 способами:
жидкое-твердое
жидкое-газообразное
твердое-газообразное
Взаимосвязь между химическим потенциалом и энергией Гиббса:
Известно выражение
![]()
Его интегрирование для однокомпонентной системы:
![]()
если
![]()
Т.е. химический потенциал = энергии Гиббса одного моля чистого компонента
