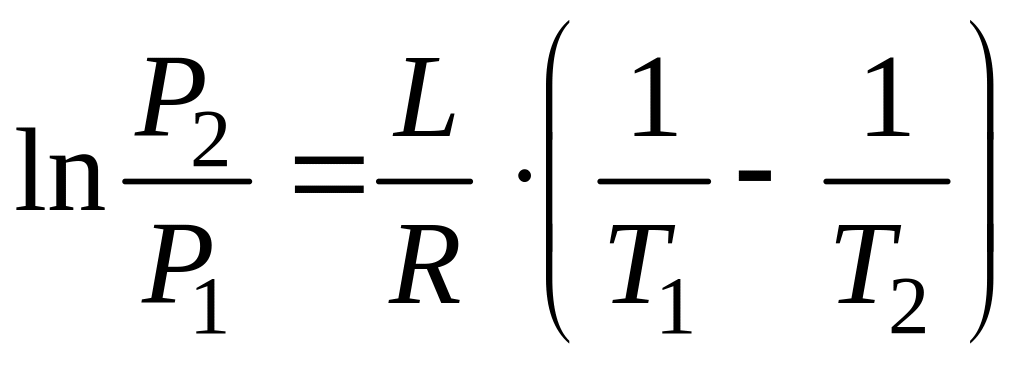- •Фазовое равновесие.
- •Условия равновесия фаз
- •Правила фаз Гиббса
- •Однокомпонентные системы.
- •Фазовая диаграмма однокомпонентной системы.
- •Равновесие чистого вещества в двух фазах однокомпонентной системы. Уравнение Клапейрона - Клаузиуса
- •Двухкомпонентные системы (растворы)
- •Коллигативные свойства предельно разбавленных растворов.
- •2. Повышение температуры кипения растворителя над раствором
- •3. Понижение температуры замерзания растворителя над раствором
- •4. Осмос
- •Концентрированные идеальные растворы
- •Состав пара над идеальным раствором
- •Построение диаграммы температура-состав. Законы Коновалова
- •Неидеальные растворы
- •Состав пара над неидеальным раствором.
Фазовая диаграмма однокомпонентной системы.
Любая фазовая диаграмма или диаграмма состояния строится только по экспериментальным данным, при этом используются два принципа:
Принцип непрерывности: при непрерывном изменении параметров состояния (Р, Т и состав) свойства фаз на диаграмме меняются также непрерывно, пока не изменятся число и характер фаз.
Принцип соответствия: числу фаз, одновременно находящихся в равновесии, на диаграмме соответствует определённый геометрический образ. Линия – две фазы, точка – три фазы.
При построении диаграммы выбирается число осей координат, соответствующих выбранным параметрам состояния (для однокомпонентной системы на плоскости могут быть изображены Р и Т; для двухкомпонентной системы – Р или Т и состав; для трёхкомпонентной системы - только состав).
Пример: Диаграмма состояния воды.
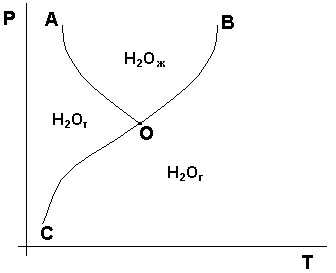
АО – кривая плавления;
ВО – кривая кипения;
СО – кривая возгонки;
Для этих трёх случаев, исходя из правила Гиббса для однокомпонентной системы (К = 1)
C = 3 – Ф; Ф = 2; С = 1; т.е. можно менять в некоторых пределах либо Р, либо Т.
О – тройная точка, все 3 фазы находятся в равновесии.
H
 2Oж
H2Oт
H2Oг
2Oж
H2Oт
H2Oг
Ф = 3; С = 0, т.е., чтобы не нарушить одновременное сосуществование всех трех фаз, Р и Т должны быть зафиксированы (Р = 5,575 мм.рт.ст., t = 0,0076°С).
Для полей твёрдой СОА, жидкой АОВ и газообразной ВОС фаз, число степеней свободы С = 2.
Равновесие чистого вещества в двух фазах однокомпонентной системы. Уравнение Клапейрона - Клаузиуса
Такое равновесие (как видно из вышеприведённого примера) может быть реализовано тремя вариантами: твёрдое – жидкое; жидкое – газообразное; твёрдое – газообразное.
Например: Разберём равновесие жидкость – пар. Как было выше показано, равновесию соответствует равенство химических потенциалов в обеих фазах, т.е.
μп = μж, соответственно dμп = dμж.
μi = VidP – SidT;
VпdP – SпdT = VжdP – SжdT;
(Vп – Vж)dP = (Sп – Sж)dT;
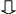
∆V ∆S
|
(1) – Уравнение Клапейрона – Клаузиуса в дифференциальном виде.
Для практических целей это уравнение интегрируют, применяя следующие допущения:
∆V ≈ Vп (объёмом жидкой фазы пренебрегают).
Пар считают идеальным газом, т.е.
P V
= RT
V
=
V
= RT
V
=
![]() – подставляем в уравнение (1);
– подставляем в уравнение (1);
∆S
=
![]() – подставляем в уравнение (1);
– подставляем в уравнение (1);
При подстановке в уравнение (1), получаем:
![]() ,
интегрируем:
,
интегрируем:
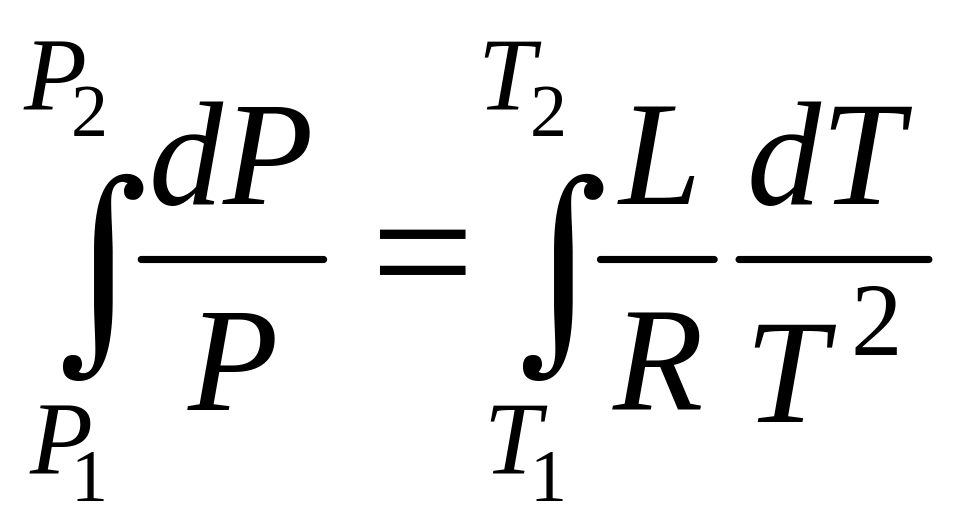
Двухкомпонентные системы (растворы)
Истинный раствор – это однофазная, гомогенная система, образованная не менее чем двумя компонентами. Растворы могут быть газообразные, твердые или жидкие. Наиболее часто встречаются последние.
В жидких растворах различают:
Растворитель (компонент находящийся в избытке)
Растворенные вещества.
В жидком растворителе может быть 3 типа растворенных веществ: газообразные, твердые, жидкие.
Важнейшей характеристикой любого раствора является его концентрация, которая может быть выражена различными способами.
Физическая химия использует 3 шкалы:
Молярная
![]()
Моляльная ![]()
Рациональная,
выраженная через мольные доли:
![]()
![]()
Идеальные растворы – это растворы, образование которых не сопровождается тепловыми эффектами (H = 0) и изменением объема (V = 0), а изменение энтропии равно таковому при смешении идеальных газов (S = Sид.газа).
Предельно разбавленные растворы – в них концентрация растворенного вещества относительно невелика.
В – растворенное вещество; NB ≤ 0,1 – в этих растворах растворитель считается идеальным.