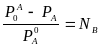- •Фазовое равновесие.
- •Условия равновесия фаз
- •Правила фаз Гиббса
- •Однокомпонентные системы.
- •Фазовая диаграмма однокомпонентной системы.
- •Равновесие чистого вещества в двух фазах однокомпонентной системы. Уравнение Клапейрона - Клаузиуса
- •Двухкомпонентные системы (растворы)
- •Коллигативные свойства предельно разбавленных растворов.
- •2. Повышение температуры кипения растворителя над раствором
- •3. Понижение температуры замерзания растворителя над раствором
- •4. Осмос
- •Концентрированные идеальные растворы
- •Состав пара над идеальным раствором
- •Построение диаграммы температура-состав. Законы Коновалова
- •Неидеальные растворы
- •Состав пара над неидеальным раствором.
Коллигативные свойства предельно разбавленных растворов.
При анализе этих свойств считается, что природа растворенного вещества не важна и свойства определяются только его количеством. Кроме того, по пунктам 1-4 растворенное вещество не летуче.
Закон Рауля (относительное понижение давления насыщенного пара растворителя по отношению к раствору)
Ранее показано, что
![]()
Для 1 моль чистого компонента
![]() ,
поэтому
,
поэтому ![]() ,
где
,
где
![]() – стандартный
химический потенциал i-го
компонента
– стандартный
химический потенциал i-го
компонента
![]() –стандартные
условия
–стандартные
условия
|
Для предельно
разбавленного раствора
![]() ,
а для идеального газа
,
а для идеального газа
![]()
Закон Рауля описывает равновесие жидкость – пар, где условием равновесия будет
![]()
A – растворитель
В – растворимое вещество
АВ – раствор
Для предельно разбавленного раствора
![]()
Дифференцируем
![]() ,
т.к.
,
т.к.
![]() ,
,
![]()
Интегрируем

Для чистого
растворителя NA
= 1,
![]() – давление
насыщенного пара чистого растворителя.
– давление
насыщенного пара чистого растворителя.
![]()
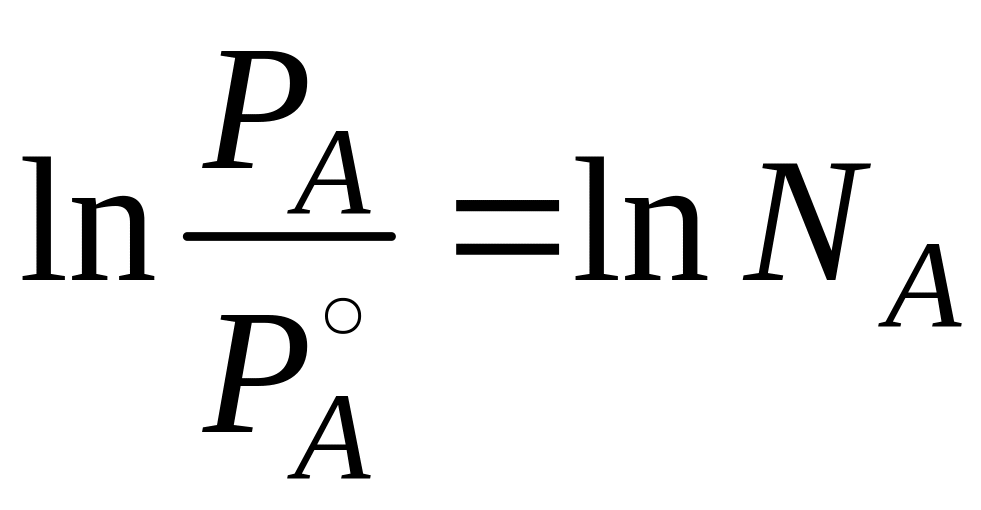
-
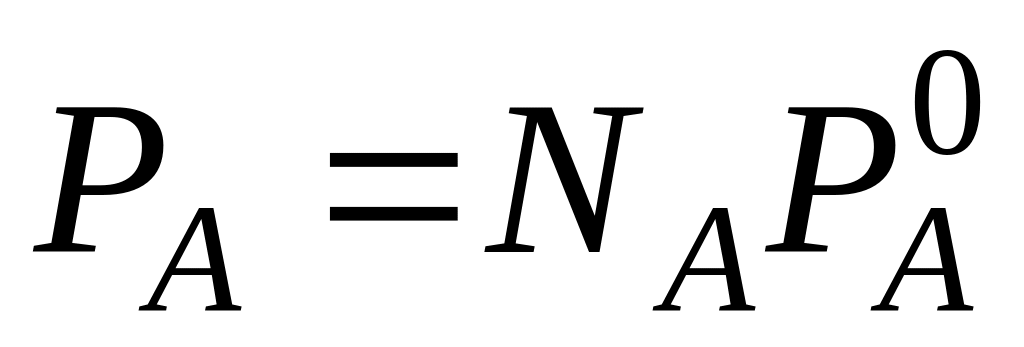
– закон Рауля
![]()
![]()
![]()
![]()
|
2. Повышение температуры кипения растворителя над раствором
и
3. Понижение температуры замерзания растворителя над раствором
Разберем на диаграмме состояния воды (растворитель)
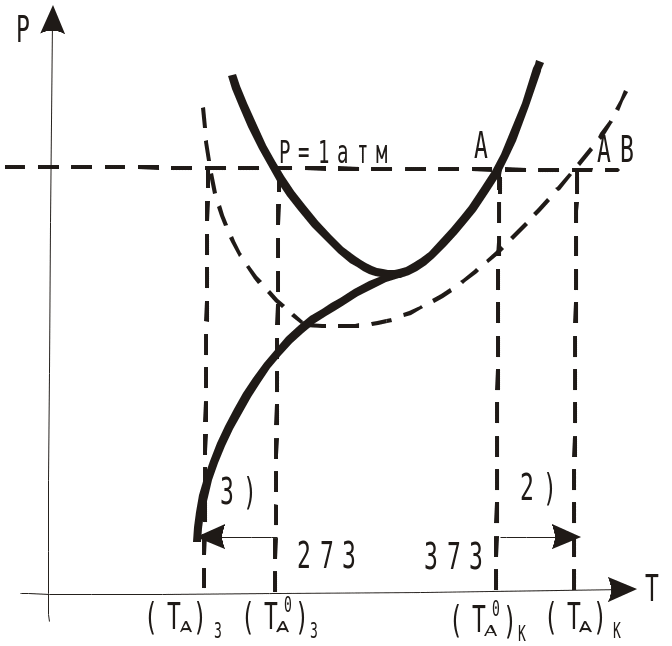
А – растворитель ; Т0к – для чистого растворителя; Т0к – для растворителя над раствором;
АВ – раствор
К – кипение
З – замерзание
Кипение проходит, когда давление насыщенного пара растворителя будет равна атмосферному. Исходя из закона Рауля, давление пара растворителя над раствором меньше, чем над чистым растворителем, поэтому, чтобы раствор закипел, температура смещается в область более высоких температур.
![]()
![]() – повышение
температуры кипения раствора
пропорционально моляльной концентрации
растворимого вещества.
– повышение
температуры кипения раствора
пропорционально моляльной концентрации
растворимого вещества.
Е – эбулиоскопическая константа
![]()
![]() – температура
замерзания смещается в область низких
температур.
– температура
замерзания смещается в область низких
температур.
К – криоскопическая константа
Обе константы Е и К индивидуальны для различных веществ (справочник).
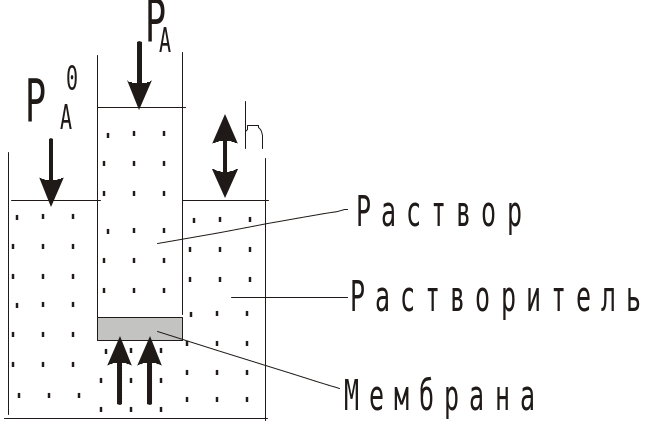
4. Осмос
![]() (Рауль) или
(Рауль) или
![]()
Осмос – самопроизвольный переход молекул растворителя через полупроницаемую мембрану (перегородка проницаемая только для молекул растворителя) в раствор. При этом высота столба жидкости в трубке будет увеличиваться. Когда она достигает некоторой высоты, h осмос прекратится. Гидростатическое давление, которое нужно приложить к раствору, чтобы предотвратить осмос, называется осмотическое (П). Его можно вычислить по уравнению Вант-Гоффа

П = CBRT
Осмос лежит в основе протекания многих биологических процессов: 5%-ный раствор сахара в крови дает П = 0,6 атм.
Примечание: в растворах электролитов, где число частиц гораздо больше исходных молекул (при диссоциации) во все уравнения в п. 1 – 4 вводится поправка «i» – изотонический коэффициент. Для предельно разбавленных растворов, где электролит достигает 100% диссоциации, поправка i равна числу ионов, на которые распался электролит.
Например: П = CBRTi
NaCl Na+ + Cl– i=2
Fe2(SO4)3 2Fe3+ + 3SO42– i=5
![]()
5. Давление летучего растворенного вещества над предельно разбавленным раствором. Закон Генри (установлен опытным путем)
При равновесии
![]()
![]()
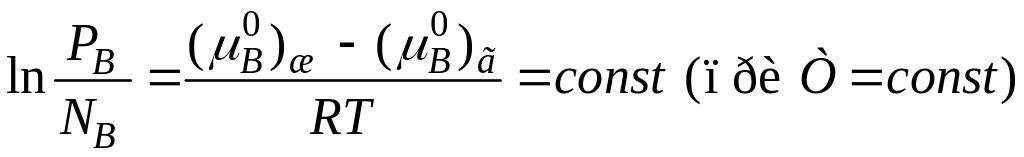
Потенцируем:
PB = NB, где – константа Генри (имеет размерность давления).
![]() ;
NB
= 'PB; где
;
NB
= 'PB; где
![]()
Закон Генри: Мольная доля газа в растворе прямо пропорциональна давлению газа над раствором – применим только к идеальным растворам
Примечание: Закон Рауля является частным случаем закона Генри, когда
Pi0 = const
Влияние температуры на растворимость: чем больше температура, тем меньше растворимость и наоборот. Для растворов электролитов растворимость газа увеличивается, если он образует с ионами химическое соединение – эффект всаливания. Если растворимость газа в растворе электролита уменьшается – эффект высаливания.