
Уравнение Ван-дер-Ваальса
В случае идеального газа для одного моля , n=1.
В случае реального газа взаимодействие
приводит к тому, что давление увеличивается:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
где a — постоянная
величина,
,
где a — постоянная
величина,
![]() .
.
Изотермы газа Ван-дер-Ваальса. Опыт Эндрюса. Критическая температура
Исследования показали, что при измерении температуры идеального газа вид изотермы меняется не только в количественном виде, но и в качественном отношении. Типичная зависимость представлена на рисунке. Эта зависимость получена теоретически:

При некоторых высоких температурах изотерма реального газа напоминает изотерму идеального газа. При понижении температуры, начиная с некоторой критической температуры, на изотерме появляется точка перегиба. А при дальнейшем понижении температуры появляются провалы.
Экспериментально изотермы реального газа были получены Эндрюсом в1865 году. Суть в следующем: оказалось, что для реального газа вместо провала и горба на кривой наблюдается участок, показанный пунктиром. И на этих кривых есть три участка.
Когда разность объёмов стремиться а нулю при приближении к температуре, то эту температуру называют критической температурой.
Внутренняя энергия реального газа равна сумме кинетической энергии хаотического движения молекул и их взаимной потенциальной энергии.
Внутренняя энергия идеального газа представляет собой только кинетическую энергию хаотического движения молекул, поэтому
![]()
![]()
![]()
![]() -изменение
внутренней энергииреальногогаза
-изменение
внутренней энергииреальногогаза
Д.Джоуль и У. Томсон экспериментально обнаружили, что при адиабатном расширении газа без совершения полезной работы температура газа изменяется. Процесс такого необратимого расширения называется абиабатным дросселированием, а явление изменения температуры в этом процессе- эффектом Джоуля-Томсона.
![]()
![]()
![]()
![]()
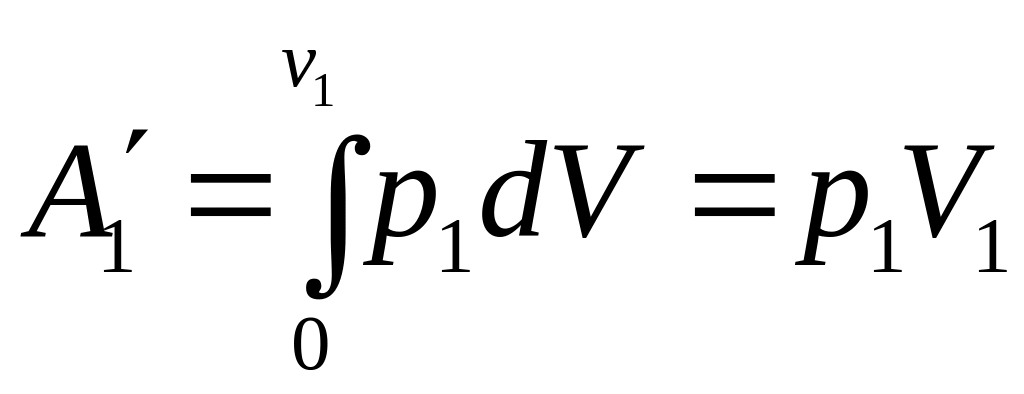
![]()
![]()
![]() -
эффект Джоуля-Томсона.
-
эффект Джоуля-Томсона.![]()
Фазой называется система с одинаковыми фазовыми свойствами во всех точках с ограниченной поверхностью раздела.
Фазовым переходом называется переход вещества из одной фазы в другую.
При фазовом переходе первого рода требуется затратить или отдать некоторое количество теплоты, свойства системы изменяются неразрывно (парообразование, плавление).
При фазовом переходе второго рода физические свойства системы изменяются скачком. Теплоты не поглощается и не выделяется. Примерами служат переходы He1 в He2, переход проводника в сверхпроводящее состояние.
Процессы
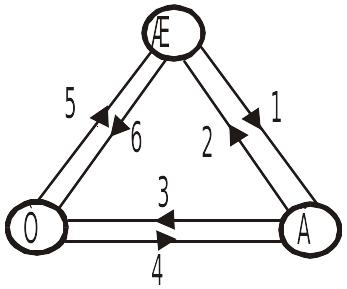
1. Плавление (выделяется теплота).
2. Кристаллизация (поглощается теплота).
3. Испарение (выделяется теплота).
4. Конденисация (поглощается теплота).
5. Конденисация.
6.
Сублимация.![]() .
.
