
Основы молекулярной физики и термодинамики.
Суть статистического метода
заключается в том, что поведение большого
числа частиц подчиняется, так называемым,
статистическим закономерностям. В этом
случае нам совершенно не важно, с какой
скоростью движется та или иная отдельная
частица системы, а нас будут интересовать
некие средние параметры этой системы
(например,
![]() ,
,
![]() ).
).
Идеальный газ - это газ, в котором отсутствуют силы межмолекулярного взаимодействия, т . е. молекулы считаются упругими твердыми шариками соударения между которыми абсолютно упругие, силы притяжения межу ними отсутствуют.
Вывод уравнения МКТ газов для давления.
Термическое уравнение состояния
идеального газа, называемое уравнением
Клайперона:
![]() .
Для данной массы отношений произведения
давления и объема к термодинамической
температуре есть величина постоянная.
.
Для данной массы отношений произведения
давления и объема к термодинамической
температуре есть величина постоянная.
Газовая постоянная С зависит
от химического состава газа и
пропорциональна его массе
![]() .
Так как
.
Так как
![]() ,
где
,
где
![]() - удельный объем газа, то уравнение
Клайперона можно переписать в форме
- удельный объем газа, то уравнение
Клайперона можно переписать в форме
![]() ,
где
,
где
![]() - удельная газовая постоянная,
зависящая только от химического состава
газа.
- удельная газовая постоянная,
зависящая только от химического состава
газа.
![]() .
Если
.
Если
![]() - масса одной молекулы, то масса
произвольного количества вещества
- масса одной молекулы, то масса
произвольного количества вещества
![]() равна
равна
![]() ,
где
,
где
![]() - молярная масса газа. Молярным
объемом называется величина
- молярная масса газа. Молярным
объемом называется величина
![]() .
Перепишем уравнение состояния в форме
.
Перепишем уравнение состояния в форме
![]() и
и
![]() (*), где
(*), где
![]() - молярная газовая постоянная.
Согласно закону Авогадро, при одинаковых
давлениях и температурах молярные
объемы различных газов также одинаковы.
- молярная газовая постоянная.
Согласно закону Авогадро, при одинаковых
давлениях и температурах молярные
объемы различных газов также одинаковы.
Из этого закона и уравнения следует,
что молярная газовая постоянная
![]() одинакова у всех газов. Поэтому ее
принято называть универсальной газовой
постоянной. Экспериментально установлено,
что
одинакова у всех газов. Поэтому ее
принято называть универсальной газовой
постоянной. Экспериментально установлено,
что
![]() .
Для произвольной массы
газа
можно переписать уравнение (*) в виде
.
Для произвольной массы
газа
можно переписать уравнение (*) в виде
![]() - уравнение Клайперона-Менделеева. Из
него получается, что плотность газа
- уравнение Клайперона-Менделеева. Из
него получается, что плотность газа
![]() .
Употребляется еще одна форма уравнения
(*). Введем постоянную Больцмана
.
Употребляется еще одна форма уравнения
(*). Введем постоянную Больцмана
![]() ,
равную отношению универсальной газовой
постоянной
к постоянной Авогадро
,
равную отношению универсальной газовой
постоянной
к постоянной Авогадро
![]() :
:
![]() .
Из уравнения (*) получим
.
Из уравнения (*) получим
![]() ,
где
,
где
![]() – концентрация молекул газа.
– концентрация молекул газа.
Средняя кинетическая энергия молекул.
Средняя кинетическая энергия молекулы
одноатомного газа (она имеет три степени
свободы поступательного движения) равна
кинетической энергии молекулы, движущейся
со скоростью, равной средней квадратичной
скоростью:
![]() .
Заменив
.
Заменив
![]() по формуле
по формуле
![]() ,
получим
,
получим
![]() .
.
Внутренняя энергия
включает в себя энергию всевозможных
видов движения и взаимодействия всех
частиц ( молекул, атомов, ионов и т.д.),
образующих рассматриваемую систему.
Внутренняя энергия идеального газа
зависит только от его массы, химического
состава и температуры. Внутренняя
идеального газа представляет собой
кинетическую энергию его молекул. Для
одного моля:
![]() .
.
Число независимых возможных перемещений механической системы называется числом степеней свободы этой системы.
Функцией распределения
называется относительное число частиц
![]() приходящихся на заданный интервал
скоростей.
приходящихся на заданный интервал
скоростей.
![]() ,
,
![]() .
.
Теплоемкость
Различают удельную теплоемкость и молярную. Под удельной теплоемкостью понимают количество теплоты, которое необходимо для нагревания единицы массы на единицу температуры. Под молярной теплоемкостью понимается величина , численно равная теплоте, которую нужно сообщить одному молю вещества для изменения его температуры на 1К в рассматриваемом термодинамическом процессе.
В случае многоатомных газов, если они
идеальны, на каждую степень свободы
приходиться в среднем энергии
![]() ,
а число степеней свободы определяется
суммой степеней свободы поступательного,
вращательного и колебательного движений.
В общем случае
,
а число степеней свободы определяется
суммой степеней свободы поступательного,
вращательного и колебательного движений.
В общем случае
![]()
![]() .
.
Из этого следует, что теплоемкость
идеальных газов не зависит от температуры,
т. к.
![]() ,
,
![]() .
Однако опыт показал, что это утверждение
справедливо лишь для одноатомного газа.
.
Однако опыт показал, что это утверждение
справедливо лишь для одноатомного газа.
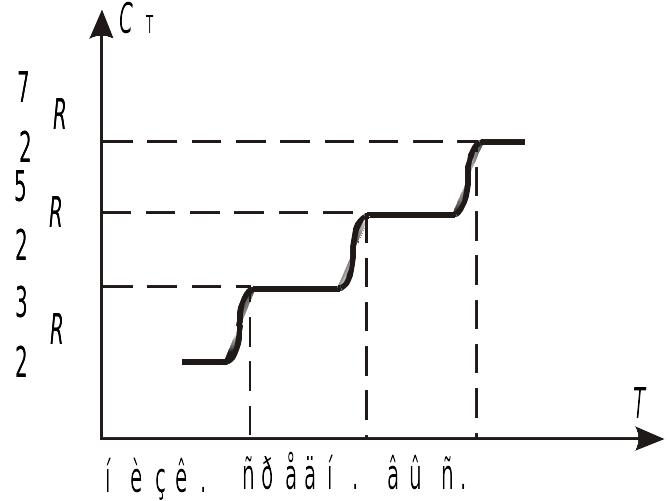
Для двухатомных газов при низких
температурах
![]() ведет себя как
ведет себя как
![]() ,
,
![]() ,
а при высоких —
,
а при высоких —
![]() .
Это означает, что в различных интервалах
температур число степеней разное. При
низких температурах присутствуют только
поступательные степени свободы. При
средних температурах возбуждается еще
две вращательные степени свободы, а при
более высоких еще две колебательные
степени свободы. Указанная зависимость
показывает, что энергия поступательного
и колебательного движения квантуется,
т. е. пока температура не достигает
определенного значения, вращательное
и колебательное движение не возбуждается.
По аналогии можно ввести понятие
квантование вращательного и квантование
колебательного движения.
.
Это означает, что в различных интервалах
температур число степеней разное. При
низких температурах присутствуют только
поступательные степени свободы. При
средних температурах возбуждается еще
две вращательные степени свободы, а при
более высоких еще две колебательные
степени свободы. Указанная зависимость
показывает, что энергия поступательного
и колебательного движения квантуется,
т. е. пока температура не достигает
определенного значения, вращательное
и колебательное движение не возбуждается.
По аналогии можно ввести понятие
квантование вращательного и квантование
колебательного движения.
Закон Больцмана для распределения частиц во внешнем силовом поле. барометрическая
Для однородного гравитационного поля
![]() .
.
![]()
В состоянии термодинамического равновесия все параметры ( темп., давление, плотность и др. (макроскопические ) ) одинаковы, однако если каким-то образом изменить один (или несколько) из этих параметров в какой-то области, то система станет неравновесной и в этой системе возникнут процессы, возвращающие систему в равновесное состояние – явление переноса.
1)Перенос тепла - теплопроводность
2)перенос массы - диффузия
3)перенос импульса – внутреннее трение или вязкость.
Диффузия — явление переноса, которое связано с градиентом концентрации и оно наблюдается из области, где концентрация газа повышена, и из той области, где концентрация газа меньше.
Получим уравнение диффузии.
Рассмотрим два объема газа
![]() и
и
![]() .Пусть
концентрация в объеме A
больше, чем в объеме B.
Выделим площадку
.Пусть
концентрация в объеме A
больше, чем в объеме B.
Выделим площадку
![]() на расстоянии
на расстоянии
![]() от начала координат, предполагая, что
объем
и
находятся на расстоянии меньше длины
свободного пробега. Если в точке
концентрация
от начала координат, предполагая, что
объем
и
находятся на расстоянии меньше длины
свободного пробега. Если в точке
концентрация
![]() ее,
то в области
,
находящейся на расстоянии
ее,
то в области
,
находящейся на расстоянии
![]() ,
для концентрации мы можем записать
следующую формулу:
,
для концентрации мы можем записать
следующую формулу:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
![]() — закон Фика,
— закон Фика,
![]() — коэффициент диффузии.
— коэффициент диффузии.
Вязкость. Рассмотрим поток
частиц, движущихся в направлении
![]() .
Предположим, что в этом потоке имеется
два слоя с разными скоростями
.
Предположим, что в этом потоке имеется
два слоя с разными скоростями
![]() и
и
![]() .
Поскольку частицы движутся хаотично,
они могут попадать из одного слоя в
другой. Если частица из медленного слоя
попадает в быстрый слой и наоборот, то
импульс быстрого слоя за время
.
Поскольку частицы движутся хаотично,
они могут попадать из одного слоя в
другой. Если частица из медленного слоя
попадает в быстрый слой и наоборот, то
импульс быстрого слоя за время
![]() будет уменьшаться на величину
будет уменьшаться на величину
![]() .
Отсюда (по второму закону Ньютона
.
Отсюда (по второму закону Ньютона
![]() )
будет следовать наличие силы, тормозящей
быстрый слой и ускоряющей медленный.
)
будет следовать наличие силы, тормозящей
быстрый слой и ускоряющей медленный.
![]() ,
,
![]() ,
,
![]() .
.
![]() — уравнение внутреннего
трения,
— уравнение внутреннего
трения,
![]() — динамический
коэффициент вязкости.
— динамический
коэффициент вязкости.
Теплопроводность.
Выделим в среде элементарный параллелепипед
с ребрами
![]() ,
,
![]() ,
,
![]() .
Т. к. температуры граней различны, то
через параллелепипед проходит теплота
в направлении осей
,
.
Т. к. температуры граней различны, то
через параллелепипед проходит теплота
в направлении осей
,
![]() ,
.
Через площадку
,
.
Через площадку
![]() за время
,
согласно уравнению Фурье, проходит
количество теплоты
за время
,
согласно уравнению Фурье, проходит
количество теплоты
![]() .
Через противоположную грань на расстоянии
отводится количество теплоты
.
Через противоположную грань на расстоянии
отводится количество теплоты
![]() ,
где
,
где ![]() —температура
второй грани, а величина
—температура
второй грани, а величина
![]() определяет изменение температуры в
направлении
.
определяет изменение температуры в
направлении
.
![]() .
Итак, приращение внутренней энергии
в параллелепипеде за счет потока тепла
в направлении оси
равно:
.
Итак, приращение внутренней энергии
в параллелепипеде за счет потока тепла
в направлении оси
равно:
![]() .Приращение
внутренней энергии в параллелепипеде
за счет потока тепла в направлении оси
выражается аналогичным уравнением:
.Приращение
внутренней энергии в параллелепипеде
за счет потока тепла в направлении оси
выражается аналогичным уравнением:
![]() .А
в направлении оси
:
.А
в направлении оси
:
![]() .Полное
приращение внутренней энергии в
параллелепипеде:
.Полное
приращение внутренней энергии в
параллелепипеде:![]() .
С другой стороны, согласно закону
сохранения энергии:
.
С другой стороны, согласно закону
сохранения энергии:
![]() ,
где
,
где
![]() — объем параллелепипеда,
— объем параллелепипеда,
![]() — масса параллелепипеда,
— масса параллелепипеда,
![]() — удельная теплоемкость среды,
— удельная теплоемкость среды,
![]() —
плотность среды,
—
плотность среды,
![]() — изменение температуры в данной точке
среды за время
.
— изменение температуры в данной точке
среды за время
.
![]() ,
или
,
или
![]() .
.
Величину
![]() называют оператором Лапласа и обычно
обозначают сокращенно
называют оператором Лапласа и обычно
обозначают сокращенно
![]() .
.
![]() — уравнение Фурье,
— уравнение Фурье,
![]() — температуропроводность.
— температуропроводность.
Средняя длинна свободного пробега.
Поскольку
![]() вероятная порядка
вероятная порядка
![]() ,
можно было бы ожидать, что эти процессы
протекают очень быстро, однако это не
так и причина заключается в столкновениях
между частицами. Расстояние, которое
проходит частица в промежутке между
двумя последними столкновениями
называется длиной
свободного
пробега
,
можно было бы ожидать, что эти процессы
протекают очень быстро, однако это не
так и причина заключается в столкновениях
между частицами. Расстояние, которое
проходит частица в промежутке между
двумя последними столкновениями
называется длиной
свободного
пробега
![]() .
.
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
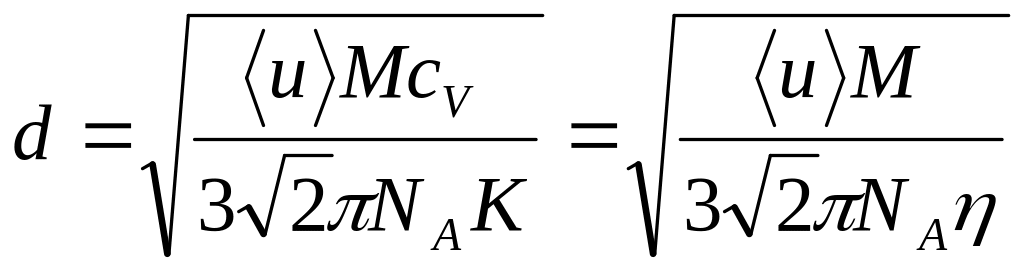 - эта формула позволяет по известным из
опытов значениям коэффициентов переноса
и характеристикам газа ( средней скорости
молекулы приданной температуре, удельной
теплоемкости и молярной массе) определить
эффективный диаметр.
- эта формула позволяет по известным из
опытов значениям коэффициентов переноса
и характеристикам газа ( средней скорости
молекулы приданной температуре, удельной
теплоемкости и молярной массе) определить
эффективный диаметр.
Газ, давление которого ниже нормального
атмосферного давления, называется
разряженным газом. Такое состояния газа
называют также вакуумом.
Различают низкий вакуум![]() ,
средний вакуум (
,
средний вакуум (
![]() )
и высокий вакуум (
)
и высокий вакуум (![]() ).
).
Первое начало термодинамики — это закон сохранения энергии в тепловых процессах. Полная энергия термодинамической системы складывается из макроскопической (энергия тела как единого целого) и микроскопической (внутренней энергии). Внутренняя энергия может изменяться:
путем совершения работы (системы над системой);
путем передачи теплоты;
путем химического, электромагнитного и других видов взаимодействия.
Если считать, что в системе могут
происходить процессы только первого и
второго пункта, то оказывается, что
справедлив следующий закон:
![]() .Этот
закон известен как первое начало
термодинамики, т. е. количество теплоты,
подводимое к системе, идет на изменение
внутренней энергии dQ
плюс работа, совершаемая системой
над внешними телами dA.
Если над системой совершают работу, то
из этого закона следует невозможность
так называемого вечного двигателя
первого рода, т. е. если к системе не
подводить теплоту, то эта система сможет
совершать работу только за счет запаса
внутренней энергии:
.Этот
закон известен как первое начало
термодинамики, т. е. количество теплоты,
подводимое к системе, идет на изменение
внутренней энергии dQ
плюс работа, совершаемая системой
над внешними телами dA.
Если над системой совершают работу, то
из этого закона следует невозможность
так называемого вечного двигателя
первого рода, т. е. если к системе не
подводить теплоту, то эта система сможет
совершать работу только за счет запаса
внутренней энергии:![]() ,
,![]() ,
,![]() .
.
Тепловое и адиабатическое взаимодействие. Температура.
В зависимости от того, в какой форме передается энергия, различают тепловое и адиабатическое взаимодействия. Тепловым называют такое взаимодействие, при котором передача энергии происходит без изменения внешних параметров, например объема. Физическая величина, равная энергии, которой обмениваются системы при тепловом взаимодействии, называется количеством теплоты
.При адиабатическом взаимодействии передача энергии осуществляется посредством совершения над системой (системой) макроскопической работы. При этом макроскопические параметры системы меняются. Количество энергии, которое при этом передается, называется работой. При передаче энергии меняется скорость теплового движения (энергия теплового движения). Такой макроскопический параметр, как температура, характеризует среднюю энергию теплового движения.
1 градус по Фаренгейту равен
градус по Фаренгейту равен
![]() градуса по Цельсию.
градуса по Цельсию.![]()
Отметим, что в первом начале термодинамики dU является полным дифференциалом, а dQ и dA нет. В этой связи первое начало термодинамики иногда записывают в таком виде:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Для того чтобы изменить объем, занимаемый газом, надо совершить работу против сил давления. Рассмотрим систему:
Сила, создаваемая давлением газ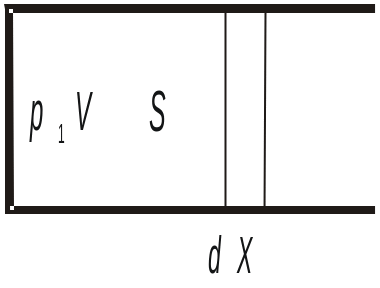
а на поршень площадью S равна:
![]()
![]() -элемент
работы совершаемой над газом, при
изменении объема на dV.
-элемент
работы совершаемой над газом, при
изменении объема на dV.
Договоримся, что работа, совершаемая внешними силами над газом имеет знак «-», а работа газа при увеличении его объема имеет знак «+».
Первое начало термодинамики — это закон сохранения энергии в тепловых процессах. Полная энергия термодинамической системы складывается из макроскопической (энергия тела как единого целого) и микроскопической (внутренней энергии). Внутренняя энергия может изменяться:
1. путем совершения работы (системы над системой);
2. путем передачи теплоты;
3. путем химического, электромагнитного и других видов взаимодействия.
Если считать, что в системе могут происходить процессы только первого и второго пункта, то оказывается, что справедлив следующий закон:
.
Этот закон известен как первое начало термодинамики, т. е. количество теплоты, подводимое к системе, идет на изменение внутренней энергии dQ плюс работа, совершаемая системой над внешними телами dA. Если над системой совершают работу, то из этого закона следует невозможность так называемого вечного двигателя первого рода, т. е. если к системе не подводить теплоту, то эта система сможет совершать работу только за счет запаса внутренней энергии:
,
,
Изотермический процесс
— это процесс изменения параметров
системы, протекающий при постоянной
температуре, т. е.
![]() и
и
![]() .
Закон Бойля-Мариотта:
.
Закон Бойля-Мариотта:
![]() ,
,
![]() .
.
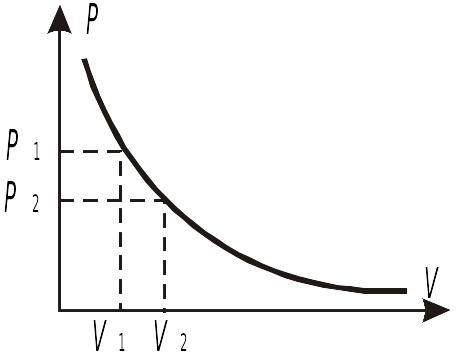
В случае изотермического процесса т. к.
![]() ,
,
![]() ,
то
,
то
![]() .
Если из уравнения Максвела-Клайперона
.
Если из уравнения Максвела-Клайперона
![]() ,
,
![]() ,
то из этого следует что
,
то из этого следует что
![]() ,
,
![]() .
.
![]() при
при
![]() (термостатическая система с
(термостатическая система с
![]() ).
).
Изохорический процесс —
это процесс изменения параметров
системы, протекающий при постоянном
объеме (![]() ).
).
![]() т.
к.
т.
к.
![]() ,
,
![]() ,
,
![]() .
.
![]() — для идеального одноатомного газа. В
случае идеального газа внутренняя
энергия равна сумме потенциальной и
кинетической энергии, но потенциальной
энергией мы пренебрегаем
— для идеального одноатомного газа. В
случае идеального газа внутренняя
энергия равна сумме потенциальной и
кинетической энергии, но потенциальной
энергией мы пренебрегаем
![]() ,
,
![]() ,
,
![]() .
.
Если число степеней свободы не 3, то
![]() (для многоатомных газов),
(для многоатомных газов),
![]() ,
,
![]() ,
,
![]() .
.
Обращаем внимание: теплоемкость это величина, зависящая от количества степеней свободы. Если же одинаковый объем, но различные газы, то чем больше степеней свободы у данного газа, тем большее количество теплоты требуется для его нагревания
Адиабатический процесс —
это процесс, протекающий без теплообмена
с окружающей средой. Реально это либо
быстрые процессы, либо происходящие в
системах, заключенных в теплоизолированную
оболочку. Если на одном графике изображены
изотерма и адиабата, то адиабата идет
круче, т. к.
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
При изобарическом процессе система
расширяется и совершает работу,
следовательно, ей надо сообщить больше
теплоты, чтобы нагреть до одной и той
же температуры.
.
При изобарическом процессе система
расширяется и совершает работу,
следовательно, ей надо сообщить больше
теплоты, чтобы нагреть до одной и той
же температуры.
Изобарический процесс:
![]() .
.
Изохорический процесс:
![]() .
.
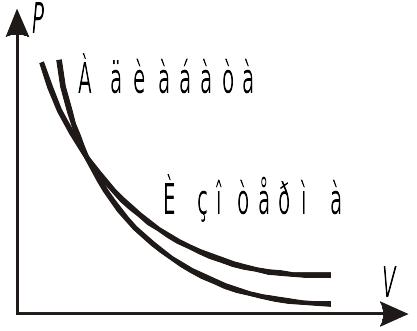
Адиабатический процесс —
это процесс изменения параметров
системы, протекающий при постоянном
давлении (![]() ).
).
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Обратимым называется такой переход системы из состояния A в состояние B, что обратный переход из B в A возможен без изменений в окружающих телах. В противном случае — процесс необратимый. Пример: упругий и неупругий удар, колебания маятника, передача тепла.
В реальных системах процесс перехода A в B может быть обратимым, если система последовательно проходит через ряд равновесных состояний (непрерывно и медленно). Такой процесс называется квазистатическим. Если после ряда превращений система возвращается в исходное состояние, процесс называется круговым или циклом.
