
- •Конспект лекций по физике
- •Раздел 5
- •Волновая оптика Электромагнитная природа света. Зависимость между длиной световой волны и частотой электромагнитных колебаний
- •Световой поток, сила света, освещенность, яркость
- •1 Кандела – 1/60 часть силы света, создаваемой 1 см² плоской поверхности платины при температуре ее затвердевания (2046 к) по направлению перпендикуляра к этой поверхности.
- •Принцип Гюйгенса. Законы отражения и преломления света
- •1. Лучи падающий и отраженный лежат в одной плоскости с перпендикуляром к отражающей поверхности, восстановленным из точки падения луча.
- •3. Падающий и отраженный лучи обратимы.
- •1. Лучи падающий и преломленный лежат в одной плоскости с перпендикуляром к отражающей поверхности, восстановленным из точки падения луча.
- •2. Отношение синуса угла падения к синусу угла преломления для двух данных сред есть величина постоянная.
- •3. Падающий и преломленный лучи обратимы. Когерентность и монохроматичность. Интерференция света
- •Дифракция света в щели и в дифракционной решетке
- •Понятие о поляризации света
- •Понятие о голографии
- •Дисперсия света. Разложение белого света призмой. Цвета тел. Виды спектров. Спектральный анализ
- •Электромагнитное излучение в различных диапазонах длин волн. Понятие о парниковом эффекте
- •Оптические приборы
- •Недостатки линз
- •Построение изображения в линзе
- •Формула линзы
- •Квантовая физика. Квантовая оптика Квантовая гипотеза Планка. Распределение энергии в спектре излучения
- •Внешний фотоэффект и его законы. Внутренний фотоэффект. Применение фотоэффекта в технике. Давление света.
- •Применение фотоэффектов в технике
- •Физика атома Радиоактивность. Опыты Резерфорда. Планетарная модель атома. Постулаты Бора
- •Экспериментальные методы регистрации заряженных частиц
- •Биологическое действие радиоактивных лучей
- •Состав ядер. Общие сведения об элементарных частицах. Ядерные силы. Дефект массы. Энергия связи
- •Ядерные силы
- •Дефект массы атомного ядра. Энергия связи.
- •Деление тяжелых атомных ядер
- •Эволюция Вселенной Термоядерный синтез. Эволюция звезд
- •Понятие о космологии. Строение и развитие Вселенной
Физика атома Радиоактивность. Опыты Резерфорда. Планетарная модель атома. Постулаты Бора
Английский физик Резерфорд заложил основы учения о радиоактивности и строении атома.
Радиоактивностью называется явление непрерывного излучения ураном без каких-либо внешних воздействий.
Резерфорд поместил радиоактивное излучение в магнитное поле, в результате чего излучение разделилось на 3 части (рисунок 35). Резерфорд установил, что две части излучения являются корпускулярными и назвал их α и β-лучами. β-лучи являются потоком быстро летящих электронов, а α-лучи – поток положительно заряженных частиц, представляющих собой дважды ионизированные атомы гелия.
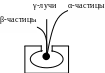 γ-лучи
не отклоняются в магнитном поле и
представляют собой очень короткие
электромагнитные волны.
γ-лучи
не отклоняются в магнитном поле и
представляют собой очень короткие
электромагнитные волны.
Радиоактивное излучение возникает при распаде ядер атомов радиоактивных элементов.
П
Рисунок
35. Опыт Резерфорда
Изотопы – это разновидности одного химического элемента, занимающие одно место в таблице Менделеева, но отличающиеся массами атомов за счет различного числа нейтронов. Так для Не (гелия) число нейтронов может колебаться от 1 до 6.
Для того, чтобы атом одного химического элемента превратился в атом другого элемента должен измениться заряд Z ядра атома. При испускании α-частицы заряд становится (Z-2) (например, из ядер атома радия образуются ядра атомов радона). При испускании β-частицы заряд становится (Z+1).
Правило смещения: При испускании α-частицы химический элемент перемещается в таблице Менделеева на 2 места влево, а при испускании β-частицы – на 1 место вправо.
После испускания α или β-частиц атомное ядро часто оказывается в возбужденном состоянии и, переходя на более низкий энергетический уровень (в нормальное состояние), излучает γ-квант.
Изучая рассеяние α-частиц при прохождении их через вещество, Резерфорд пришел к выводу, что в центре атома существует массивное положительно заряженное ядро. В 1911 году он предложил планетарную модель атома, представляющую собой подобие Солнечной системы: в центре атома находится положительно заряженное ядро, а вокруг него по орбитам движутся отрицательно заряженные электроны. Заряд ядра равен числу электронов, находящихся на орбитах.
Модель атома Резерфорда не объясняла существование спектральных линий, т.е. строго определенных длин волн излучения и поглощения атомов. Нельзя было также на ее основе объяснить и устойчивость самого атома.
Датский ученый Нильс Бор развил модель атома Резерфорда, введя идеи квантовой теории в виде 3 постулатов:
Электроны могут двигаться вокруг ядра атома только по строго определенным орбитам, соответствующим одному из энергетических уровней атома.
Когда электрон движется по одной из разрешенных орбит, атом находится в устойчивом состоянии, т.е. не излучает и не поглощает энергию.
Когда электрон перескакивает с одной из дозволенных орбит на другую, более близкую к ядру, атом испускает квант энергии (фотон) в виде излучения, частота которого определяется формулой Планка.
Из постулатов Бора следует, что величина кванта, испускаемого атомом при переходе из одного устойчивого состояния в другое, равна разности энергии атома в этих двух состояниях. Теория Бора с большой точностью объяснила спектр атома водорода и объяснила природу атомных спектров. Впоследствии была создана квантовая механика, включающая в себя теорию Бора как частный случай.
