
- •Физиология растений
- •Учебное издание
- •Isbn 5-06-001604-8
- •Глава 4
- •Глава 5
- •Глава 6
- •Глава 11
- •Глава 12
- •Устойчивость растений к низким температурам 14.5. 14.6. 14.7.
- •Глава 14
- •Строение растительной клетки
- •(Лецитин и др.) субъединица белок фермента
- •Структуры растительных клеток
- •Органы, ткани, функциональные системы высших растений
- •Отложение в запас
- •Глава 2
- •Канализированная связь
- •Гормональная регуляция
- •Генетическая система регуляции
- •18S 5,8s 28s Интрон
- •Электрофизиологическая регуляция
- •2.6. Электрофизиологическая регуляция
- •Электротонические поля и токи • растительном организме
- •Потенциал действия (пд)
- •3.1. Общее уравнение фотосинтезв
- •1 А хлорофилл ° 1/l ° *
- •I "'хЛОрОфИлл
- •3.1. Общее уравнение фотосинтеза
- •Пигменты пластид
- •Триплетное возбужденное состояние
- •Синглетное возбужденное состояние
- •Фотосистема II
- •Путь углероде в фотосинтезе (темновая фаза фотосинтеза)
- •Iifpokchcoma
- •Регуляция фотосинтеза на уровне листа
- •Механические ткани
- •2Хема клеточного строения листа дву-юльных
- •I tier
- •Регуляция процессов фотосинтеза в целом растении
- •Синтез гормонов в тканях стеблей, корней, плодов нт. Д.
- •3.6. Экология фотосинтеза
- •3.6. Экология фотосинтеза
- •Фотосинтез, рост 4 продуктивность растений
- •Космическая роль растений
- •Сопряженная эволюция типов обмена веществ и среды обитания
- •Общее уравнение дыхания
- •4.1. Общее уравнение дыхания
- •4.1. Общее уравнение дыхания
- •Снон—соон изолимонная кислота
- •Взаимосвязь различных путей диссимиляции глюкозы
- •Дыхательная электронтранспортная цепь и окислительное фосфорилирование
- •Альтернативная оксидаза
- •Сукцинил--СоА
- •Световые реакции фотосинтеза
- •Возраст листьев, дни
- •И свойства чистой воды
- •3,I чонсr fiHa ci к'„ 'I
- •5.4. Механизмы лередвижении воды по растению
- •5.4. Механизмы передвижения врды_по_растению
- •I Мир растений 1
- •Растения
- •Процессы y растений
- •Пути ассимиляции аммиака
- •Глутаминовая кислота
- •Аепарапшовая кислот а
- •Неорганический низкомолекулярныи высокомолекулярный
- •_ Трансфераза _
- •Механизмы поглощения ионов растительной клеткой
- •Радиальный и ксилемный транспорт элементов минерального питания
- •Влияние внешних и внутренних факторов на минеральное питание растений
- •Активность и минеральный состав растений
- •6 12. Экология минерального питания
- •Ние рН на доступ-минеральных ;нтов для расте-(по с. J. Pratt,
- •7,5 4,0 4,5 5,0 5,5 6,0 6,5 7,0 Очень кислые Слабо кислые
- •6.12. Экология минерального питания __ 273
- •Voop -bop
- •Питание насекомоядных растений
- •За счет собственных органических веществ
- •Глава 8
- •Глава 9
- •Функционирование специализированных секреторных структур у растений
- •Глава 10
- •Структура и синтез рнк
- •Структура и синтез белков
- •К&трилцрякии шсгимл.
- •10.2. Самосборка и биогенез клеточных структур
- •10.2. Самосборка и биогенез клеточных структур
- •1Ема фаз митоза I. С. Ledbetter, к. R. Irter, 1970)
- •Этапы онтогенеза высших растений
- •Протодерма
- •Концентрации, мг/л
- •Влияние факторов 1нешней среды на рост растений
- •Физиология размножения растений
- •Использование вегетативного размножения в растениеводстве
- •Глава 13
- •13.2. Внутриклеточные движения
- •IV. Ростовые движения (удлинение осевых органов, кру- говые нутации, тропизмы: фото-, гео-, тигмо-, хемо-, термо- и т. Д., ростовые настии: фото-, термо-, гигро-).
- •V. Тургорные движения (движения устьиц, медленные тур- горные движения — настии, быстрые тургорные движения — сейсмонастии).
- •Локомоторный способ движения у жгутиковых
- •13.3.1 Таксисы
- •13.5. Ростовые движения
- •Медленные тургорные настические движения
- •Быстрые тургорные движения (сейсмоностии)
- •Глава 14 механизмы защиты и устойчивости у растений
- •Способы защиты и надежность растительных организмов
- •Засухоустойчивость и устойчивость к перегреву
- •Устойчивость к недостатку кислорода
- •Глава 1
- •Глава 2
- •Глава 3
- •Глава 4
- •Глава 5
- •Глава 6
- •Глава 7
- •Глава 8
- •Глава 9
- •Глава 10
- •Глава 11
- •Глава 12
- •Глава 13
- •Глава 14
И свойства чистой воды
тшяшшшшт^я^ш^л
Физические
свойства воды. Вода
— самое аномальное веще-Молекулярная
ство,
хотя принята за эталон меры плотности
и объема для
cVX"rJ?°„-„r. ДРУГИХ веществ.
Плотность. Все вещества увеличивают объем при нагревании, уменьшая при этом плотность. Однако при давлении 0,1013 МПа (1 атм) у воды в интервале от 0 до 4°С при увеличении температуры объем уменьшается и максимальная плот
ность наблюдается при 4°С (при этой температуре 1 см3 воды имеет массу 1 г). При замерзании объем воды резко возрастает на 11 %, а при таянии льда при 0°С так же резко уменьшается. С увеличением давления температура замерзания воды понижается через каждые 13,17 МПа (130 атм) на 1 °С. Поэтому на больших глубинах при минусовых температурах вода в океане не замерзает. С увеличением температуры до 100 °С плотность жидкой воды понижается на 4% (при 4°С плотность ее равна 1).
Точки кипения и замерзания (плавления). При давлении 0,1013 МПа (1 атм) точки замерзания и кипения воды находятся при 0°С и 100°С, что резко отличает Н20 от соединений водорода с элементами VI группы периодической системы Менделеева. В ряду Н2Те, H2Se, H2S и т. д. с увеличением относительной молекулярной массы точки кипения и замерзания этих веществ повышаются. При соблюдении этого правила вода должна была бы иметь точки замерзания между — 90 и — 120°С, а кипения — между 75 и 100°С. Температура кипения воды возрастает с увеличением давления, а температура замерзания (плавления) — падает.
Теплота плавления. Скрытая теплота плавления льда очень высока — около 335 Дж/г (для железа — 25, для серы — 40). Это свойство выражается, например, в том, что лед при нормальном давлении может иметь температуру от — 1 до — 7°С. Скрытая теплота парообразования воды (2,3 кДж/г) почти в 7 раз выше скрытой теплоты плавления.
Теплоемкость. Величина теплоемкости воды (т.е. количество теплоты, необходимое для повышения температуры на 1 °С) в 5 —30 раз выше, чем у других веществ. Лишь водород и аммиак обладают большей теплоемкостью. Кроме тоге, лишь у жидкой воды и ртути удельная теплоемкость с повышением температуры от 0 до 35 °С падает (затем начинает возрастать). Удельная теплоемкость воды при 16 °С условно принята за единицу, служа эталоном для других веществ. Поскольку теплоемкость песка в 5 раз меньше, чем у жидкой воды, то при одинаковом нагреве солнцем вода в водоеме нагревается в 5 раз слабее, чем песок на берегу, но во столько же раз дольше сохраняет теплоту. Высокая теплоемкость воды защищает растения от резкого повышения температуры при высокой температуре воздуха, а высокая теплота парообразования участвует в терморегуляции у растений.
Высокие температуры плавления и кипения, высокая теплоемкость свидетельствуют о сильном притяжении между соседними молекулами, вследствие чего жидкая вода обладает большим внутренним сцеплением.
Поверхностное натяжение и прилипание. На поверхности воды из-за нескомпенсированности сцепления (ко-гезии) ее молекул создается поверхностное натяжение, величина которого при 18°С равна 0,72 мН/см (выше только у ртути — 5 мН/см). Вода обладает также свойством адгезии (прилипания), которое обнаруживается при ее подъеме против гравитационных сил. В капиллярах сочетаются силы сцепления молекул воды в пограничном с воздухом слое с ее адгезией с материалом стенок капилляра. В результате в капилляре образуется вогнутая поверхность воды выше ее исходного уровня. У ртути, не обладающей свойством адгезии, поверхность мениска в капилляре выпуклая. То же наблюдается в капиллярах с не-смачиваемыми водой стенками.
Молекулярное строение воды. В молекуле воды две пары электронов являются общими для ядер водорода и кислорода. Они имеют сильно вытянутые орбиты и, так как более электроотрицательный атом кислорода притягивает электроны от атомов водорода, несут частичные положительные заряды, а атом кислорода с двумя неподеленными парами электронов имеет частичный отрицательный заряд (рис. 5.1, А).
Поскольку в молекуле воды разноименные заряды пространственно разделены, она при общей электронейтральности является диполем. Вследствие того что орбиты с неподеленными электронами атома кислорода лежат в плоскости, перпендикулярной плоскости молекулы, а угол между ядрами водорода составляет 104,5° (109,5° для льда), возникает структура тетраэдра с четырьмя полюсами электрических зарядов: двумя положительными и двумя отрицательными (рис. 5.1, Б).
Каждая молекула воды, являясь диполем с тетраэдрическим распределением электронов вокруг атома кислорода, может взаимодействовать с четырьмя другими молекулами воды за счет электростатического взаимодействия атомов Н и О соседних молекул:
Н\(')/Н
9
н I
•°\
Ж' . Н. н
н 6(3) н
Молекулы 1 и 2 находятся в плоскости чертежа; 3 — над плоскостью; 4 — под ней. Такое электростатическое взаимодействие с незначительной долей ковалентности называется водородной связью. Это сравнительно слабая связь, так как в жидкой воде энергия, необходимая для ее разрыва, равна 18,84 кДж/моль (энергия ковалентной связи Н — О в молекуле воды составляет 460,4 кДж/моль). Водородные связи непрерывно возникают и разрушаются. Время полужизни каждой из них — менее 1 • 10~9с.
Ионизация. Поскольку в молекуле воды электроны прочнее связаны с атомом кислорода, происходит отщепление протонов. В результате наблюдается диссоциация молекул воды на ионы водорода (Н+) и гидроксила (ОН"). Но свободный ион Н+ не способен к самостоятельному существованию и немедленно гидратируется молекулой воды с образованием иона
Схема
расположения атомов (А)
и
избыточных зарядов (Б) в молекуле
воды
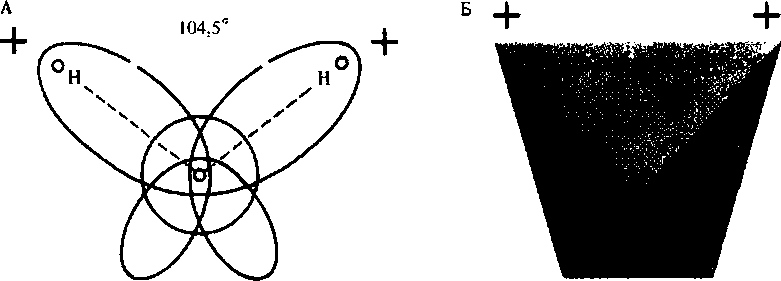
гидроксония: Н+ + Н20+± Н30+. Суммарная реакция представляет собой переход протона от одной молекулы воды к другой и образование ионов гидроксония и гидроксила: Н20 + + Н20<=* НэО+ + ОН". Для простоты изложения гидроксоний (Н30+) обычно обозначают как Н + .
При 25 °С концентрация водородных или гидроксильных ионов в чистой воде составляет 1 • 10~7 моль/л, что соответствует рН 7.
Вода как растворитель. Полярность молекулы воды обусловливает ее свойство растворять вещества лучше, чем другие жидкости. Растворение кристаллов неорганических солей осуществляется благодаря гидратации входящих в их состав ионов. Хорошо растворяются в воде органические вещества, с карбоксильными, гидроксильными, карбонильными и с другими группами которых вода образует водородные связи.
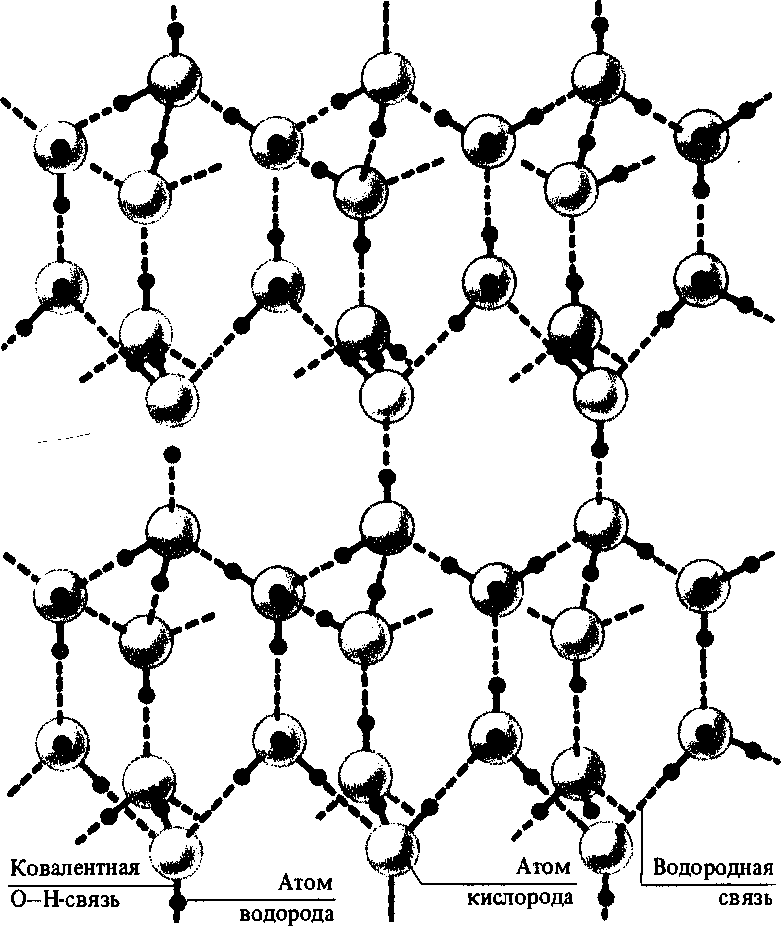
Структура льда и жидкой воды. Несмотря на интенсивные исследования, особенности структуры воды в различных ее состояниях окончательно не выяснены. В структуре льда, полученного при нормальных условиях давления (лед I), каждая молекула воды окружена четырьмя другими, образующими тетраэдр, в центре которого располагается молекула воды, связанная четырьмя водородными связями с молекулами воды, расположенными в вершинах тетраэдра. В целом образуется гексагональная кристаллическая структура льда (рис. 5.2). Среднее расстояние между атомами кислорода для льда составляет 0,276 нм. При плавлении льда увеличивается расстояние между атомами кислорода (при 15°С оно равно 0,29 нм). Одновременно разрушается около 15% водородных связей. Вместо 12 ближайших молекул у каждой молекулы воды оказываются от 3,4 до 4,5 соседних молекул.
Существуют две группы гипотез, объясняющих структуру жидкой воды. К гипотезам первой группы относится представление О. Я. Самойлова (1946, 1957) о том, что жидкая вода обладает однородной (ажурной) льдоподобной структурой, в пустотах которой находятся мономерные молекулы воды, не имеющие или имеющие малое число водородных связей. Структура льдоподобного каркаса воды может нарушаться тепловым движением молекул и ионами, превышающими размеры пустот (К + , Rb+, Cs+), тогда как А13 + , Li + , ОН", SO|~ укрепляют однородную структуру воды. Теп-
Гексагональная
структура льда I
ловое движение молекул воды осуществляется по полостям каркаса, не связанным друг с другом водородными связями.
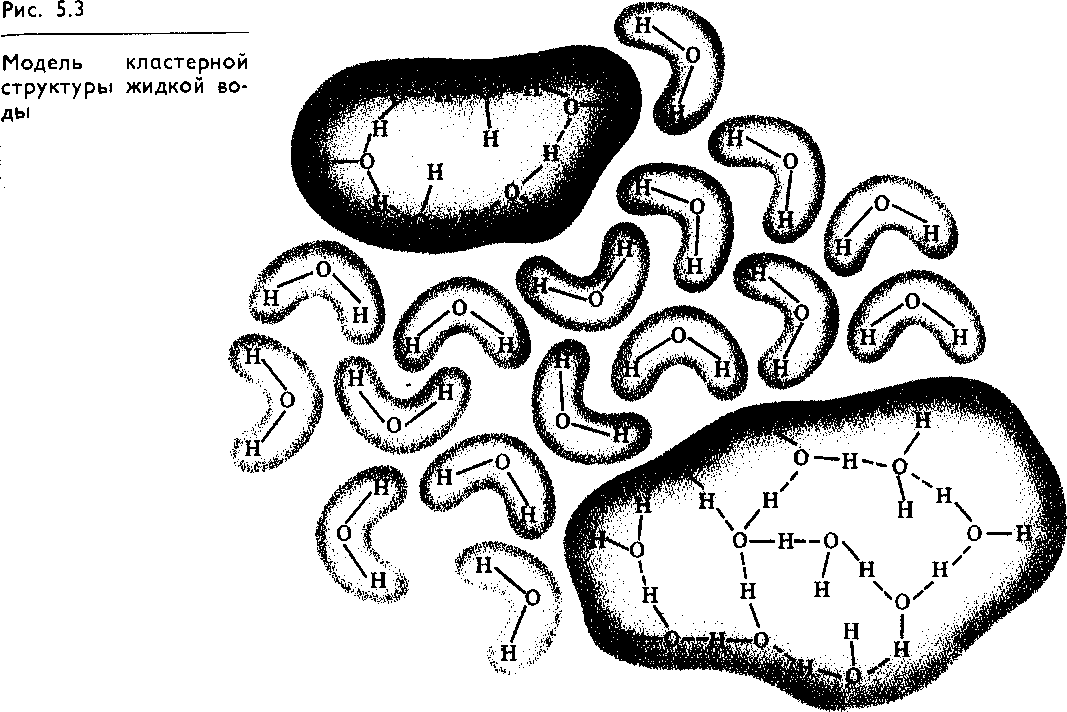
Согласно гипотезам второй группы вода представляет собой равновесную смесь льдоподобных образований и мономерных молекул (рис. 5.3). «В жидкой воде появление участков (мастеров, роев), объединенных взаимодействующими водородными связями, чередуется с областями, где водородные связи отсутствуют или реализованы лишь частично. Чередующиеся зоны, или «мерцающие кластеры», возникают и исчезают вследствие локальных энергетических флуктуации. Время жизни кластеров 10~10— Ю-11 с. В каждый данный момент времени в образовании «мерцающих кластеров» участвует до 2/з молекул воды.
Возможно, что между этими группами гипотез нет принципиальных различий. Их объединяют следующие представления: существование водородных связей, участвующих в создании организованных структур; существование двух типов структур: с упорядоченной ориентацией молекул (льдоподоб-ная структура, кластеры) и неупорядоченной структуры
*^^я^^тш1т^ш Растворы электролитов. В растворах, содержащих ионы, Состояние воды структура воды существенно меняется. В разбавленных раство- в растворах рах (< од моль/л) это происходит благодаря заряженным ио-
нам. Эффект зависит от поляризующей силы иона, которая определяется плотностью заряда (отношение заряда иона к его радиусу). Маленькие ионы с большой плотностью заряда сильнее действуют на структуру чистой воды по сравнению с большими ионами, имеющими малую плотность заряда. И те и другие разрушают структуру воды: первые притягивают молекулы воды, вторые при внедрении в воду из-за большого размера разрушают льдоподобный каркас. При этом может меняться вязкость водного раствора: структура, создаваемая слабогидратированными большими ионами (с малым зарядом), делает вязкость раствора ниже вязкости чистой воды (Li + , Na+, Mg2+, F"), а более плотная структура, образуемая гидратированными ионами, обусловливает более высокую вязкость, чем в чистой воде (К + , Rb + , NH^, Cs + , С1~, ОН", NO J и др.).
В электрическом поле катиона все ближайшие молекулы воды ориентируются отрицательными полюсами внутрь (рис. 5.4), а вокруг аниона внутрь направлены положительные полюсы молекул воды. Этот внутренний, прочно связанный с ионом слой молекул воды называют первичной, или ближней, гидратацией (сольватацией) (рис. 5.5). В процессе электрофоре-
с малым числом водородных связей; разрушающее влияние те- плового движения молекул на структуру воды; кооперативные 5-2-2 свойства воды.
Ориентация
молекул воды вокруг катиона и аниона

за он движется вместе с ионом как одно целое. Однако ион, связывая определенное число молекул воды из своего непосредственного окружения, в результате ион-дипольного взаимодействия ориентирует также более далеко расположенные диполи воды. Эту гидратацию называют вторичной или дальней.
В состоянии первичной гидратации молекулы воды имеют сниженную подвижность и находятся в обменном равновесии с ближайшими молекулами. А молекулы вторичной гидратной оболочки, сохраняя подвижность, под поляризующим влиянием иона стремятся к некоторой упорядоченности, что нарушает исходную структуру воды. С наружной стороны этого слоя вода сохраняет неизменную структуру.
Воду, связанную с ионами, называют также осмотически связанной. Она является важной составляющей осмотического давления в клетках растений.
По мере повышения концентрации раствора (до 1,5 — 2 моль/л) вторичные гидратные оболочки ионов перекрываются и вода с собственной структурой перестает существовать: наблюдается переход от структуры чистой воды к структуре кристаллогидрата. Чем больше ионов в растворе, тем больше нарушена структура воды и, следовательно, тем меньше энергии необходимо для разрушения оставшихся водородных свя-
Модель
гидратации иона

Ион
Первичная гидратационная оболочка
Вода с ненарушенной структурой (вторичная гидратационная оболочка) Вода с нарушенной структурой
ис.
5.6
ависимость
теплоем-ости водных раство-ов от
концентрации лектролитов — бро-1ида
калия
и броми-того тетрабутилам-ония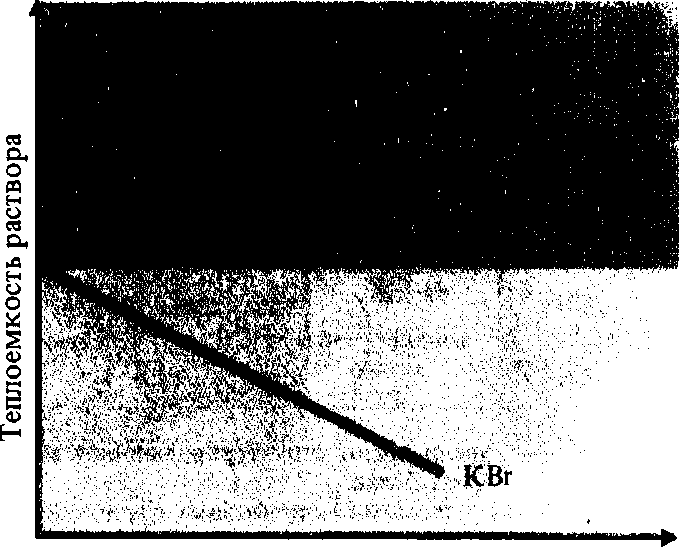
Концентрация вещества
зей и повышения температуры раствора. На рис. 5.6 представлена зависимость теплоемкости водного раствора от концентрации растворенного электролита (КВг). При повышении концентрации КВг теплоемкость воды снижается из-за дезорганизации системы водородных связей в структуре воды. Эти данные позволяют понять природу высокой теплоемкости воды и характер влияния на эту теплоемкость растворенных в воде веществ.
Влияние гидрофобных радикалов на структуру воды. При
растворении в воде вещества с большим гидрофобным радикалом, например тетрабутиламмонийбромида (C^g^NBr, и с увеличением его концентрации в растворе теплоемкость раствора повышается (рис. 5.6). Это объясняется тем, что неполярные молекулы увеличивают степень структурной организации воды. Вокруг них образуются кристаллогидраты с пентагональными ячейками. Например, (C4HQ)4NBr образует кристаллогидрат, масса которого на 90% состоит из кристаллической воды. Вода в этом кристалле имеет высокую теплоемкость: кристалл плавится не при 0°С, как лед, а при 30 °С. Возникновение кристаллогидратов можно наблюдать в производственных условиях в газопроводах. Описаны случаи закупорки льдом труб газопровода при 20 °С (образование кристаллогидрата около молекул метана), а также замерзания зерна и повреждения посевов от появления льда в тканях при 4,5°С (образование кристаллогидратов около неполярных радикалов макромолекул белков).
Растворы белков. В белках гидратация обусловлена взаимодействием молекул воды с гидрофильными (ионными и электронейтральными) и гидрофобными (неполярными) группами и ее иммобилизацией в замкнутых пространствах внутри ма-кг> моле ул пои их конбоома ионных перест ойках.
При гидратации ионной (взаимодействие с — NH3", — СОО"-группами) и электронейтральной (с —СООН, —ОН, -СО, -NH, -NH2, — CONH2-rpynnaMH) молекулы воды электростатически связываются и образуется мономолекулярный слой первичной гидратации. Число ионизированных групп в белке зависит от рН среды. Наименее гидратирован белок в его изоэлектрической точке, при которой отмечается также самая низкая растворимость белков. Гидрофобные группы, например аланина ( —СН3),
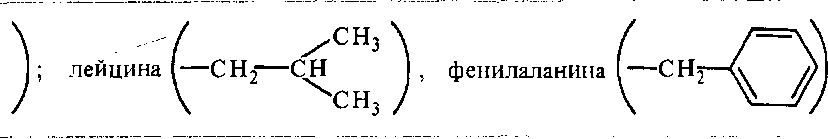
увеличивают структурированность воды в этих участках молекулы белка.
Помимо гидрофобных групп в молекулах белков, на структурированность воды влияет гидрофобная липидная фаза мембран.
Иммобилизованная вода, оказавшаяся замкнутой внутри макромолекул, может участвовать в образовании слоя первичной гидратации, а остальная ее часть сохраняет свойства обычной воды, но с ограниченной подвижностью.
Растворимость белков в воде варьирует в широких пределах. Определенной зависимости между гидратацией и растворимостью белков не наблюдается. Например, сухой коллаген способен связать гораздо больше воды, чем сухой сывороточный альбумин. Однако коллаген нерастворим в воде, а альбумин растворяется в ней легко. На возможность гидратации белков за счет пептидных связей указывает тот факт, что искусственный полипептид нейлон, не содержащий боковых ио-ногенных цепей и гидрофильных групп, способен связывать воду.
Таким образом, макромолекулы оказывают разнообразное влияние на окружающую воду. В зависимости от физико-химических свойств (наличие полярных, неполярных, ионизированных групп), конформационного состояния и внешних условий (рН, ионный состав)* может наблюдаться большее или меньшее связывание воды и образование стабильной льдопо-добной структуры.
Содержание воды в растительных тканях представляет собой исключительно изменчивую и динамическую величину. Оно сильно различается у разных видов, в различных частях растений, претерпевая сезонные и суточные изменения в одних и тех же тканях. Изменения обусловливаются возрастом ткани, доступностью почвенной влаги и соотношением поглощения воды и транспирации.
В клетках и тканях различают две формы воды — свобод^ Hjj^oiTCBspaHHyK). Связанная вода подразделяется на: а) йязан-'""Itiyio осмотТ1Чёски"(гидратирует растворенные вещества — ионы, молекулы); б) коллоидно связанную, которая включает интра-
MlMl. I 'Kjln , I ,i , li f > i i ,4, , , i ч Л 111 I I I til , 1 I.V i м . i I i I
'i ' i'i • ii ь ,i i 4i,ii(i о .м| . i чей1 v ч.■ ,• i ,1 i ;>\ 'i, j ) 'я;
< ' . i' ,' I t к 1 I ' 1 ' Hi J 1 Uli <1 ' ( t I I I i ■ ,1
\!h;, uj i ..an i.i'i, но (-ич ань' i (п..v. vui i i.s i ii. n 'ii>,ii » i. ик i •
t' I i ' ' , \ ' n. ,n I ,v ,l
и i. , у „I, ,t i.i i , ; > 4 ' . > i ,м i, i о . i i i „ , j ( i
Mil - III 1 -I > * t\ II i H> ■ 11 'b - s. 11С I * fill '!<i'l' -11(1 •• J . • 'PHil {V С I ' -
ti (1, I ,i' 1 i ' \ ,,|l up, ,1, i i , | I,, , i M , , i, if
I 1 н > i i i'i [R i 1 h ., • . i> • Ь,, I ,,hiii \ , / iii, i I
Mi пб;М il> С- М1Ш' I' 1(4' 11 i 4 M t 1 I( i Hip" 4 1!
' ', I 1' I, (i il, HU f I. M li, i.i 4.i i|' i i. ,1 'I I 1
<.U> ' 1*1 , pii1 i I'iM!, ,• 1П , u i l ,1, . 1ИЧ , 1
i '"i M 'Mi t ' i К I II >.!,' i, ,4 .'I' i M." 1 ii I, ' I'l
меристем, имеющих лишь малочисленные мелкие вакуоли
И I lllklu ' Ч Ь1 V • .1 i.l'lt i ''Hi 1 Ill4 'I . ,' Hi i .1 1 I • Hi I A I
' i, Lit • V
Ь ,' i|i i 11 11 i ii> к in ■ ii,"- i • i
Oh K.' i IDII i.)B ! 1 kl lulil CU i.|iji„ll,l',l bl.nil ,111 к. \|i,il!l UlU'i.' \ )1и|н'Ч • i l.J'iU li \ l • ' 1 i * v ' < i li i ,i '.If I '
i|i, li ii'i'l 1 M' * .1 I 'i i f . 0 i I , »i ''!)
I !!pi'\t'' НИ 'ИМ" < Mi1 0 , VI I in I" >s Cl< i"<\ I !>IH KM'"'
' ' I i> , ' "!' I 1 , \'
1 > I 1 1 I • I ill. I ' l\ I I ' I • (И,! U 1 I I I II. 1
■ ' I 1 I ■ l.f Ii 'HI I- t ' ' ,' II. I И I ' .SH I I Ml
Клеточные стенки обладают значительной гигроско-
|i.l ,! Ч • . • |1 I | 1 141 И I ' ,. I . I .,1" ill' 1,1, , ■ (111
ipi I i! if >i ; M ' i "i« i ,,, i и • , ■; ii ii.i i ни . > i ■
' >i,i 'i i , 'I 'i i,i i.'l , .) '„ .(!,.' ' ii I i i',» ,
i i. bu i i ч и i in i'u i ii .i j> ч 'i.i i i\j*ii,.is >; ■ ;\ iiv i i-a
, l i i 'ii ' ' , i . •'. i i"i I , i .p. i,'i i-|| i 1 . ,v i I , '.I, itiji,
I II I 111, I 1 I.I I, I It I I 1 I I I " I'll ' ' .1
Hh i о I'j J i'.l iH'-u l h.l 11 ibl S I i л 11 Hi.! , n I 'III . 1Я( i I.I . 11 jH I . fSj),
' i 4 ( ' I I' i VI, II 1 i I I >i. I К . 1 ,'i 'I I' i
i i " P ' I "i 1. i.i i. i I ' > , i Л i 11 I i I, i
' i io1' ,[".~M.ri''M ^t> ni.'iip" юр 1 i" i.i 11 и * a i'B' 11 iie;\
i ' 111 i • I I ' " I ' 1 I I 1 , I I 1 I , I' 1 '
. ", • \i i i г I , i in ,i ' i I i i ihi i ' i 4 i ,,..i
HI I Mi • I l" > !'!. I , '• ' 4'" i if,'I i l* 11 hi. I' i Ol i .
тического да влеиия.
In ui„i,iicii к , iii " ; i ib . i i in i я i i i , i,i
1 'ill i 11 l, ' ' u> i ! -Kiln, il' I I' i' i 1 .' , li '•
ii .i'i* 'i 1 i ' i i , i- iii ill I. i i
I. Illllill il.ill L 1Ы1 Bill V!l t"1- " ".bl. ,l,.\- ' ,,K "'ill!
i,i.i i ii' I i i i'U i ' ' h ' !! I ) ч i ' i! 'i -r 'il i ' м i '
i III', IP' I'll 1 , III"! './] ' i I I l| ' I I I,
• ■(-{ I \ >f I , 1 i. I >i n i V Pi • » HI 1 i ч I )■ i ] i' k i 1 )>i II i i I tit I • 'li 1,1 . i,,, l > h i \ ' 1 ill i 1 l|1 I i HI, i'i >
i'i ii ,! i, i Hi , I I' ' , 14 1 ' i« • ' . |i, i if
I " 1
I I ,,' i I ( I ''i'i 'II 'I'I
I \ '\,i 1 i». i. ' . Mi ' u 11' IV i ' I' ' ' Mi I* i 1 ,11,
' i ,1 .' I < 1 Oi'bi'liln M.'IIM'ir iCM ' 'Шкм , i ,n\ ( il i i ii
ibSl.il'Ci i Прпо i CI ВИС',' S> HH\ l ШЫК.ИО Ш'ЦЧ 1 l,,l HUM
и iii'i'/fim ibiiii- i . шсси миоры.- ,(•>! \ i , ,к i лв js i i m il!'' ,
M,li ,1.1 •> 1,0(4' i ilu ) If, t > i. 1 i i ,.(n ! им I ,i , ' il' , i
дриям,
Пспвос меси» но концч-нipam n воды - ь ччкс чшою t
Cl|i<M ,, f 1! J I i.i ! Ь Kill-- О 1Яр и I't i ilk . .i . (1Л il ' . ' i pu i- lldlUSi'.' ) I' ii ,1 i -i I'l if <41. 11,11.lit.Г 1 и H, U, , ,(
li if * U Д11КЧ11 i< ] ! ) v|l it. !!)}>> i .' 1Ш Г ,П I SK ,1 Ilv1 , и
otiitk-hu". спигчшнишл тип \\:n 11» ( и ил, p i opi ,n- • , ■-
. Ml * ч i^IM Hi'i '4 1 !! I" pi«i , 'li ,,1, , ,4 « ' I h '"" K.l , I 'Id-"1 ,
,' t. in >li i, ii. i ui )i i1 i ,> 1} о i i Ii i ■ > i' i mi ,i . i i h\ j цен ,1 1 \ О к Si ik'K-u , IjMK.'ll i. О M' lAilii ) , . < I , 11 .1 I <• С ' .il'hils , 11 'klH^'ii'H p,H l ,1 if, * Д.", f,14<,lb,l>il'n Hi! Г * 'il , II It I i Г ll - 1 i '
"ni| ,i i • ii ►юО ,',1'n ,), к' i'l* i,' i н-п, ; ii '
' l,i, i i,i4>;. 1 ,i ;h и i ,,ct,i u , <se 'i , /Я .и i i i'k ii cue лик I h.>"h.iIjhh i;,iii \ >> ahhoi>> i;*-i дц,, -j Lk u. ',ioaj hi
UMI.iIj л Ь .>:< I' l\tt. ' I! о i ,i >i i.lpq Ihf , ' 41,'! i "lOS ,i 1 .i i'
(,V, 1 II'" 1 illH v 11.1 i Ifli к i i l Г ,'t.f 111,),, 1 |b i 11,1 i\ i I, II
7ifU< iriilMCfH.i 1ИЯ l\' i" IvMl 4 ,1 'Mllli "j,f\ I 1 I J, <_> 1" I ,
' IdblibiM ClllKiH ,|i\! HOC! V! ПеНИЯ B'Vlbi 11 *HHbie t- it" i Kit ЧВИЯО s5> CO <ЧЧ,' ,!4t\'|i i i' , k»i<e
(Jcmim: « el /> >,ikt>HM i >( i;,/ti i' ii ( u,1 |.ц ii|" 'и 'in i ,ii ibopm'iM в ,\к i Hi sp • i iCicH,^,,.i in !'.,i' '.o :,1 ,i шиц,|. им
\1CMih I'liiij (l Пр01<\.'1чШ>и]Л1 ) i I 'I Bliptll .' lb. ,--i 1С \iO icl ' i4
;nic, i i-(H'4,m.i ч i <чс i;i
П|1'|(М )\ ill 'ili'ul ''!'! 1, Mil, . \\ 1 к i'll i'' 111' if 1 iCpHb'l! ilCMOM.' p i*UJ 1 i ■>1K,i p\ 11' Ъ ' l 'j ;l U,'4\ К ч!
Фп'11'i ii'iini i Ь'Ч р<н IlpiHi'iiu Mi'ic i '*i'\;.ii,, iv ii" , ,•
П , n i , ЧП111 1 i I Iv ,1,1"! :n 'i ', l!|»l|)il" 'It 1Г ,' I, i ' ,,! ' I'.'h , K.SblHI'l-.lf f! , >.l,i; ' . ' Р'Г.Ь'Н) 1,1,(1(1 llii, iC •( СМИ,' ,p,
йичкчч) ,aho шл ic я paciKi. p.ivi c.i\,,pa aw ipvs 01 о i hi июи.ц
111 ' Hlll'Cl bJ ! loOK 1,1 'S I'lv Л 4 i'll •( ll> ,|'|Ы .) '.',', 10 H ' 1 ,1 if' II m >. к Я 11 ii,( M . I - ii II Wl ы /i i ' , ii 1 1 а' и -i I', '11 1 i
WHICH.« Я Д|с ! 14)!lit (MC'II 11 liC И» и о in 'Hn.ii -i ''. 11,1-1',>l
цлемимч и ^lc i 'снно нррннказшчи ra\:ip Miin;i i ^mi'ici rn.ni-
И'1'1 IlDcpCMll ,i- МП 4'>C КО' (1 lii 1СП1 '
111' ,.4 , ,1".'| I i i'l ,l> K, h, 1 p I, 111 iV 1» V-i Ml I 11 , , h, ' 4,V ' , <l , ПЧ l> I i |iC(j'jll-i'.i ,1 ( k,,|! ul.MCN'Cin Oil 1' i 1.1 1 'li i 1 IV,! (-41
>, 'Cii-iii- Otii'U.cii ft* v.'" \\\ i '■' ri-iii 'I ijiJHiP'ii'b'ii i <ч ■ Ни i nyi]'i ij'i'Hi i i • , ; ь ,i,i i, i-i i, >. i. г с . >!.!)- I -и ' ,' i
It.ill iii'i' к 4j f J \ 1 j к , ' -v\ l "v1' , 1Г i 1 I t I -if v. 1 > ,
i I pit t<, i»,M'i,icii. i яиц mi isemet i » чира - , iji-liiipi' мм ч,ц., ,i ,4'p.i • i ii.nM i,u i 1 с к ■ i,'i| • r.jH i( i< га л , Hi. i, < ni'r |4» in, и'
K' il' ( II I 'i< N Ii,' С ' ,<,1П'Ш.« и .1 ' I 'If i' , 1,1 ' l-i" ,4 ' i i >li-4>
! ,iKit', ii p.iiiii ,1 Hii«('.'ii' ,чк i ч 'in.I in i 'oi, ' i i ',ii 14 r с •
'i HOC i 1. и (k) IVnjiOliHU.lOMOC 1 ь Cv« v (4
П ' > MiCHil' '.i- \U 1, ',.(0И1 |-.i , in , - 111 СЧ', ' , 1.111, \ , jHK 4 I 'lil'l i, i Ф, I ,(,! "И MHil i ' ' , M . II .1 i - 4 > 'и if J I !■ i
pOHil i H Mill'l'M-1 i'hhui '"• • p\," t iC I ч • "i't> Mi', , , •
!Ш/!|{'| I , 'i dan И'ч i' P С 11 • f\l ",KI1 II- -Ц I 1! ll,' -iiiMCill' К 4,iCl<) r ,i 4 ' (!<~f. 1 й ~ ip.'im И '|«П' ' ' I.I И ll H ui. M • 1 1.1 '111" l' ' i
г 3 Водный oOiw'i f«x,ппеяы'ич м-его
![]()
