
- •Химия отрасли
- •Часть 2
- •© Панасюк а.Л., Жирова в.В., Розправкова о.В., Лилье м.В., Богатырева е.В. Химия отрасли. Учебно-практическое пособие. – м.,мгуту, 2004
- •109004, Москва, Земляной вал, 73
- •Глава 2. Ароматообразующие вещества винограда и вина
- •Глава 3. Ферментация сырья
- •Глава 4. Образование вина
- •Брожение
- •Сахара аминокислоты
- •1. Схема Эрлиха - Нейбауэра
- •2. Схема Иошицавы-Ямада.
- •3. Схема Стикленда
- •Глава 5. Формирование вина
- •Глава 6. Созревание и старение вина
- •Глава 7 - Отмирание вина
- •Химия отрасли упп часть 2 2705
Глава 6. Созревание и старение вина
Эти стадии представляют наиболее длительный период в процессе изготовления вина. Считается, что созревание вина происходит в присутствии кислорода (при выдержке в бочках, резервуарах), а старение - в безкислородных условиях (при выдержке в бутылках, при коллекционной выдержке) - М.А.Герасимов.
При созревании и старении вина протекает ряд сложных процессов:
1. ОВ-процессы,
2. Реакция этерификации (Э),
3. Сахароаминные реакции (реакции меланоидинообразования) (КА),
4. Реакции полимеризации и поликонденсации (ПП),
5. Реакции гидролиза,
6. Седиментация.
Главенствующую роль играют ОВ-процессы, с которыми сопряжены все остальные реакции. Растворение кислорода, взаимодействие его с легкоокисляемыми компонентами вина, образование пероксидов, окисление пероксидом водорода кислот, аминокислот, полифенолов и других веществ, инициирует не только ОВ-реакции, но и реакции Э, КА, ПП и др. Наряду с этим имеется определенная взаимосвязь между Э и КА, КА и ПП. То есть, условно процесс созревания вина можно изобразить схемой:

В

 кус ОВ вкус,
цвет, прозрачность
кус ОВ вкус,
цвет, прозрачность
Б

 укет
укет
Э КА ПП
В развитии вкуса вина, тонов созревания (выдержки) вносит вклад каждая из реакций. Букет формируется главным образом под влиянием ОВ, Э и КА. Цвет и прозрачность (выпадение осадков) зависят от ОВ, ПП и КА.
В вино поступает кислород, который активизирует цикл ОВ-реакций; при этом образуются вещества, которые катализируют реакции этерификации и другие циклы. Следует отметить, что существует связь между малыми циклами.
6.1. Окислительно-восстановительные процессы
По мнению ряда ученых эти процессы являются основными в формировании вкуса, и букета выдержанных вин. Вместе с тем, в науке существуют различные точки зрения на роль кислорода при созревании. Ряд ученых считают необходимым ограничить поступление кислорода в вино, напротив, другие специалисты предлагают вводить кислород для улучшения созревания. В настоящее время считают, что для созревания вина определенного типа необходимо строго определенное количество кислорода.
Для белых столовых и шампанских виноматериалов скорость ассимиляции вина кислородом должна составлять 0,02-0,05 мг О2/дм3 вина в сутки, для десертных 0,1-0,2 мг О2/ дм3 вина в сутки, для крепленых 0,2-0,3 мг О2/ дм3 вина в сутки.
Т.е., для вина определенного типа важна скорость поступления кислорода. Если скорость поступления кислорода ниже указанных пределов, то состав вина изменяется незначительно и типичные качества на развиваются. Если выше, то начинают преобладать процессы, характерные для вин последующей группы. Скорость ассимиляции вином кислорода зависит от состава вина, от температуры, при которой вино выдерживают, от концентрации растворенного кислорода.
Согласно предложенной Г.Г.Агабальянцем научной классификации вин по степени окисленности различают вина (показатель окисленности - содержание ацетальдегида и диацетила):
1. Неокисленные (столовые, десертные, полусладкие типа Шато-Икема и десертные мускаты, игристые вина);
2. Полуокисленные с заметными тонами окисленности (некоторые столовые вина южных районов, десертные вина токайские, типа кагора, малаги, типа портвейна);
3. Окисленные с интенсивными тонами окисленности и тонами мадеризации (вина типа мадеры и марсалы);
4. Сильно окисленные с ясно выраженными хересными тонами (вина типа хереса).
По мнению Г.Г.Агабальянца в неокисленных винах содержание уксусного альдегида не должно превышать 20-30 мг/л и оно повышается от первой к последней группе.
А.К.Родопуло и А.Ф.Писарницким в качестве показателя окисленности вин предложили оценивать содержание диацетила. В неокисленных винах оно не превышает 0,8 мг/л, в окисленных - свыше 1-2 мг/л.
Ацетальдегид Диацетил
(мг/л) Неокисленные (мг/л)
 0 0
0 0
Натуральные
Белые
Игристые
Полусухие
Полусладкие
Мускатные
100 1,0
Полуокисленные
Столовые вина
южных регионов
Сладкие и ликерные
Токайские
Малага
Портвейн
200 2,0
Окисленные
Марсала
Мадера
300 5,0
Очень окисленные
Херес
400
Катализаторы процессов окисления
Как показали исследования многих ученых, для начала процесса окисления кислород должен быть активирован. Существует несколько механизмов, предложенных различными учеными.
Различают биохимические (ферменты) и неорганические катализаторы (соли тяжелых металлов).
Биологические катализаторы
Характеристику, названия и реакции биологических катализаторов см. в разделе “Ферменты-оксидоредуктазы”.
В вине активность большинтсва ОВ-ферментов (оксидоредуктаз) невысока. Особое значение они имеют в технологии шампанского при выдержке вина на дрожжах, когда активность дегидрогеназ в вине велика.
Из оксидаз в столовых и крепленых винах невысокую активность проявляют ПФО и пероксидаза. Эти оксидазы сохраняются в активном состоянии, если при получении вина не происходило размножение дрожжей. Размножающиеся дрожжевые клетки адсорбируют оксидазы винограда, гидролизуют их. В результате гидролиза белков получаются АМК. В случае если, размножение дрожжей в вине было ограничено, то оксидазы остаются в активном состоянии в вина. При доступе воздуха они ускоряют окислительные процессы. В результате такие вина быстро темнеют и приобретают склонность к оксидазному кассу. Оксидазный касс наблюдается также у вин, полученных из гнилого винограда. Плесень, развивающаяся на винограде, содержит активные окислительные ферменты: ПФО, которая, попадая в вино, вызывает побурение вина. Однако, в большинстве вин, активность оксидоредуктаз незначительна и при созревании, основную роль играют неорганические катализаторы.
Неорганические катализаторы
Установлено, что ионы меди и железа (Cu+, Cu+2, Fe+2, Fe+3) являются катализаторами окислительных реакций в вине. Французскими учеными - Женевуа и Ж.Риберо-Гайоном и А.К.Родопуло показано, что комплексно связанные ионы железа являются более сильными катализаторами, чем неорганические соли железа. Установлено, что таким мощным катализатором является комплексная соль железа и винной кислоты:
СОО

СНОН
 Fe
Fe
СНОН
СОО
В комплексных солях переход из 2-х валентного железа в 3-х валентное и наоборот является обратимым, что обусловливает высокую эффективность данной системы. Существуют несколько теорий по механизму действия неорагнических катализаторов. наиболее вероятной является теория, согласно которой комплексно связанные соли тяжелых металлов образуют соединения с субстратом окисления, активируют газообразный кислород, присоединяясь к нему, при этом получается отрицательно заряженный кислород, который активно окисляет субстрат.
По данным А.П.Баха молекула кислорода непосредственно с водородом связываться не может. Вначале он должен вступить в реакцию с ненасыщенными веществами, которые он назвал оксигеназами. При этой реакции образуются вещества типа пероксидов, где кислород находится в активном состоянии:
R 1-CH=CH-R2 + O2 R1-CH-CH-R2 + R3H2 R3O +H2O + R1-CH=CH-R2
O---O оксид
перекись
Далее перекись передает кислород какому-то веществу, при этом образуется оксид, вода и регенерируется оксигеназа.
Освобожденная оксигеназа может вновь присоединять кислород и реакция продолжается. такими оксигеназами являются аскорбиновая, фумаровая и диоксифумаровая кислоты, ненасыщенные жирные кислоты (линолевая, линоленовая), терпеноиды, полифенолы и др.
В последнее время в химических и биохимичесикх процессах, и в частности, в ОВ-процессах, особое значение придают анион-радикалу О2- (часто его называют супероксидом), который образуется при одноэлектронном восстановлении молекулярного кислорода и при энзиматическом аэробном метаболизме. Механизм образования О2- следующий:
F e, Cu + O2 O2-- - супероксид (обладает очень высокой активностью и вызывает окисление компонентов).
O 2-- +RH2 RO + H2O
Кроме того, возможно взаимодействие данного анион-радикала непосредственно с Н2О2, в результате чего образуется гидроксильный анион-радикал:
О 2- + Н2О2 О2- + ОН- + ОН*.
ОВ-системы сусла и вина
Процессы окисления и восстановления в вине являются сопряженными, т.е. одно вещество окисляется, отдает атомы водорода, при этом одновременно другое вещество восстанавливается:
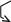 A BH2
C Z
A BH2
C Z
O 2*
AH2 B CH2 ....... ZH2
O2*- окисляет в первую очередь те вещества, которые имеют высокий ОВ-потенциал. При этом расходуются самые восстановленные вещества - редуктоны. Если требуется получить неокисленные вина (белые, столовые, шампанские), следует, чтобы в вине содержалось большое количество редуктонов (аскорбновая кислота). Следует также отметить, что терпеноиды играют в вине роль антиокислителей, т.к. содержат двойные связи.
По современным представлениям окисление и восстановление сопровождается переносом электронов. Интенсивность ОВ-процессов в вине характеризуется ОВ-потенциалом (редокс-потенциал), который зависит от соотношения ОВ-систем в вине.
В вине содержатся обратимые и необратимые ОВ-системы. При доступе кислорода равновесие реакции сдвигается в сторону окисленных форм, при анаэробной выдержке - в сторону восстановленных форм. Наличие дрожжей в вине способствует усилению восстановительных процессов. По мнению ряда ученых, это связано с проходом из дрожжевых клеток восстановителей (глютатиона, цистеина и др.). Важное значение имеют ферменты дрожжей, особенно дегидрогеназы, которые ускоряют реакции восстановления окисленных соединений. Созревание различных типов вин должно протекать при определенном уровне ОВ-потенциала. Наиболее важными ОВ-системами являются следующие:
1. Обратимые системы
1.
СООН СООН СООН
СНОН -2Н С-ОН -2Н С=О +О2 СООН
 -2СО2
-2СО2
СНОН +2Н С-ОН +2Н С=О СООН
СООН СООН СООН
винная диоксифумаровая дикетоянтарная щавелевая
кислота кислота кислота кислота
2.
СООН СООН
-2H
 СНОН
С=О
СНОН
С=О
+2Н
СН2 СН2
СООН СООН
яблочная щавелевоуксусная
кислота кислота
3.
СН3 СН3
-2H
 СНОН
+2Н С=О
СНОН
+2Н С=О
СООН СООН
молочная ПВК
кислота
4. -2H
С Н3-СН2-ОН СН3-СН=О
+2Н
этанол уксусный альдегид
5.
СН2-СН-СООН CH2-CH-COOH
SH NH2 -2Н S NH2

SH NH2 +2Н S NH2
CH2-CH-COOH CH2-CH-COOH
цистеин цистин
6.
 С=О
С=О
С=О
С=О

С-ОН -2H С=О

С-ОН O +2Н С=О O
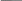 СH
СH
СH
СH
СНОН СНОН
СН2ОН СН2ОН
аскорбиновая дегидроаскорбиновая
кислота кислота
7.
С Н3-СН-СН-СН3 -2H СН3-СН-СО-СН3 -2H СН3-СО-СО-СН3

ОН ОН +2Н ОН +2Н
2,3-бутандиол ацетоин диацетил
8.
НО 8 О 1 В ОН -2Н
 7
2
7
2
А С +2Н
6 3
5 4 полифенол
ОН
 О
О
НО 8 О 1 В О
7 2
А С
6 3
5 4
ОН
Хинон
9.
Глютатион -2H Глютатион
о кисленный восстановленный
кисленный восстановленный
+2Н
2. Необратимые системы
1. +O2
С Н3-СН=О СН3-СООН
ацетальдегид уксусная кислота
2. -H2
Н 2О2 О2
3. +1/2O2
H 2SO3 H2SO4
4. -e
F e2+ Fe3+
5. -e
C u+ Cu2+
Каждая система имеет свою степень восстановления. Самый высокий ОВ-потенциал у системы полифенол-хинон, самый низкий - этанол-ацетальдегид.
Большое значение имеет система винная кислота - диоксифумаровая - дикетоянтарная, яблочная -щавелевоуксусная, Fe2+ - Fe3+. Предполагают, что системы винная кислота - диоксифумаровая кислота являются фактором, предопределяющим созревание вин.
В результате исследований было установлено, что при превращении терпеновых спиртов - гераниола и линалоола реакции окисления протекают интенсивнее при температуре 40ОС. Наибольшим изменениям они подвергаются в присутствии дрожжей.
По современным представлениям терпеноиды обусловливают сортовой аромат виноматериалов. Если ставится задача сохранения сортового аромата в винах, следует не допускать окисления терпенов, выдержку производить при пониженной температуре, сокращать срок выдержки вина, исключать тепловую обработку.
От интенсивности протекания ОВ-процессов зависит скорость созревания вина.
Как уже отмечалось выше, для каждой категории вина требуется определенное количество кислорода.
Рассмотрим следующий график:
Процесс ассимиляции кислорода вином в сутки


С, кислород, (мг/ дм3)

IV сильно окисленные

III окисленные

II слабоокисленные

I неокисленные

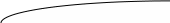

, сут
Т.е., чем больше скорость ассимиляции кслорода, тем более окисленными получаются вина.
Работы кафедры также показали, что ОВ-процессы в вине носят характер осциллограммы с постепенным падением концентрации восстановленного вещества:


С, катехин
 Н2О2
Н2О2

 Н2О2
Н2О2
Редуктон


 Редуктон Н2О2
Редуктон Н2О2


, сутки
ОВ-реакции имеют очень сложный характер, и оказывают решающее значение в формировании качетсва вина.
Наряду с ОВ-реакциями существуют еще 3 процесса.
6.2. Реакции этерификации
Реакция этерификации- это реакция взаимодействия кислот со спиртами. В вине реакции этерификации могу протекать ферментативным путем (при брожении и выдержке) и неферментативным путем (реакции идут очень медленно). Созревание вина в присутствии дрожжей протекает при хересовании и шампанизации, при этом процессы этерификации катализируются ферментами эстеразами (гидролазы эфиров карбоновых кислот). По данным Э.Пейно в вине этерифицируется 30-40% кислот, остальные считаются неэтерифицированными даже после 20-30 лет выдержки.
Следует отметить, что винная кислота в реакции этерификации не вступает.
В вине могут образовываться средние и кислые эфиры (см. раздел “Эфиры”). Большая часть эфиров обладает сильным запахом и заметно влияет на формирование букета и вкуса вина.
Изучение механизма этерификации кислот, содержащих меченный кислород О18, показало, что процесс идет путем замещения водорода в спиртовом гидроксиле на ацильную группу кислоты. Реакция катализируется ионом водорода или недиссоциированным протоном органической кислоты и является обратимой.
Сложные эфиры в винах образуются на стадии брожения. При брожении эфиры образуются в результате взаимодействия спиртов с ацильными производными кислот, накапливающихся в вине при биосинтезе высших жирных кислот.
В процессе выдержки вина отмечается дальнейшее протекание реакций этерификации под действием эстераз дрожжей и катализаторов химической природы. Изменение концентрации эфиров при выдержке в направлении равновесия обусловливает потерю сортового аромата и оказывает непосредственное влияние на формирование букетистых свойств вина.
Реакции этерификации тесно связаны с ОВ-процессами: интенсивная аэрация вызывает улетучивание многих эфиров. Экспериментальные данные свидетельствуют, что при введении кислорода в вине образуются соединения, инициирующие реакции этерификации.
6.3. Сахароаминные реакции (карбониламинные, меланоидинообразования)
Эта реакция протекает при тепловой обработке вин, при перегонке виноматериалов на коньячный спирт, при длительной выдержке. Характерными признаками являются: снижение содержания сахаров и азота аминных групп, потемнение цвета вина, накопление различных ароматических веществ. Установлено, что реакции меланоидинообразования интенсифицируются при повышенной температуре, однако имеются данные, что и при низких температурах происходит взаимодействие сахаров и АМК, но продукты их образования отличаются от продуктов, полученных при высоких температурах.
По схеме Ходжа реакции меланоидинообразования протекают в три стадии:
1 стадия. Образуются бесцветные продукты, не поголощающие в ультрафиолетовой части спектра. На этой стадии сахара и АМК конденсируются и образуются гликозиламины:
С ахара + АМК Гликозиламины
2 стадия. Образуются вещества, обладающие максимумом поглощения при 280 нм, т.е. в ультрафиолетовой части спектра. Таким максимумом поглощения обладают вещества с ненасыщенными связями.



 D
D
УФ часть спектра
, нм
280 нм
В результате происходит:
1. Дегидратация сахаров с образованием гетероциклических альдегидов (фурфурола, метилфурфурола, оксиметилфурфурола), кетонов, альдегидов и др.
2. Распад АМК с образованием ароматических альдегидов, СО2 и NH3
3 стадия. Образуются темноокрашенные соединения коричневого цвета, имеющие максимум поглощения в видимой части спектра (400-700 нм). Здесь происходят сложные реакции полимеризации и поликонденсации с образованием гетероциклических азотистых соединений.
В связи с тем, что продукты меланоидинообразования имеют окраску, эти продукты играют большую роль в формировании окраски мадеры, портвейна, коньяков.
В результате реакции меланоидинообразования, помимо вышеперечисленных, образуется большое число ( более 50) веществ: спирты, кетоны, амины, кислоты. Считают, что меланоидины отрицательно сказываются на качестве белых столовых вин и шампанского. В реакции меланоидинообразования вместо сахара могут участвовать различные карбонильные соединения, такие как альдегиды, кетоны, а также и соединения, содержащие -NH2-группу. Отсюда название - карбониламинные реакции. В последние годы обнаружено участие полифенолов в этих реакциях. Вместо АМК в реакциях могут участвовать пептиды и белки. Ряд веществ, такие как органические кислоты, ускоряют реакции меланоидинообразования; другие вещества, и особенно сильно сернистый ангидрид, тормозят развитие реакции. Это свойство используется в технологии, поэтому для производства мадеры, портвейна нельзя допускать сильно сульфитированные виноматериалы. А белые столовые вина и шампанские виноматериалы обязательно следует сульфитировать в случае выдержки при повышенных температурах (для предотвращения реакций меланоидинообразования).
Органические кислоты (винная, фумаровая, пировиноградная) ускоряют превращения углеводов. Аскорбиновая кислота, дегидрируясь и взаимодействуя с АМК, интенсифицирует потемнение вина. Экстрактивные вещества (особенно полифенолы и азотистые вещества), ионы железа, наличие кислорода, перекисей ускоряют формирование тонов тепловой обработки. Дозирование 20-80 мг/ дм3 сернистого ангидрида ингибирует эти процессы. особенно ускоряется меланоидинообразование при повышении температуры. Вместе с тем нельзя не учитывать карбониламинных реакций при длительной выдержке вина при низких температурах 10-20 ОС. Структура продуктов реакции в этих условиях совсем иная, однако их влияние на органолептические качества игритсых, столовых и крепленых вин нельзя исключать.
6.4. Реакции полимеризации и поликонденсации
В этих реакциях участвуют продукты распада сахаров и АМК. При этом образуются темноокрашенные соединения неизученной природы - меланоидины (см. выше).
В реакциях полимеризации наиболее активно участвуют фенольные вещества. В результате полимеризации полифенолов образуются олигомерные и полимерные соединения. Олигомерные производные катехинов и лейкоантоцианов называются процианидолами.
Наряду с этим в реакциях полимеризации и поликонденсации участвуют полифенолы. Установлено, что в молодых винах молекулярная масса полифенолов составляет 200-500, тогда как в выдержанных винах их масса увеличивается до 1000 и более. Это свидетельствует о том, что фенольные вещества при созревании вин полимеризуются.
Существуют несколько точек зрения по механизиму реакций полимеризации и поликонденсации. По данным работ Дурмишидзе более вероятным является механизм Френденберга, который установил, что происходит разрыв пиранового кольца полифенолов.
Исследования кафедры позволяют заключить, что красящие вещества, выделенные из вина, включают полифенольные, углеводные и ароматические компоненты. По всей видимости, молекулы флавонов сязаны между собой с молекулами антоцианов через “ацетальдегидный мостик”, т.е. при созревании вина происходит сополимеризация фенольных соединений с ацетальдегидом, причем наиболее активно трансформируется мальвидин-3-гликозид. Именно такие комплексы ответственны за бордово-коричневые оттенки окраски выдержанных вин.
В изменении оркаски красных столовых вин при созревании можно выделить три стадии. На первой стадии в результате взаимодействия антоцианов с реакционноспособными флавонами образуются полимерные соединения с минимумом поглощения при 460 нм и плечом при 520 нм, которые имеют красно-коричневую окраску. На второй стадии протекает окислительная полимеризация полифенолов с образованием соединений, имеющих максимум поглощения при 460 нм, плечо при 520 нм в спектре вина исчезает, цвет вина становится бордово-коричневым. на третьей стадии вещества, образовавшиеся на первой и второй стадиях, выпадают в осадок и остаются только полимерные олигомеры, не имеющие максимума поглощения в видимой области, и обладающие красной окраской.
Использование метода ЯМР позволяет предположить следующие механизмы образования полимеров. При поликонденсационном процессе присоединяющаяся молекула полифенола может вступать во взаимодействие с кольцом А (наиболее вероятный механизм) или кольцом С (менее вероятный):



 О О
О О
+





n
В результате этой реакции образуется димер с молекулярной массой 514.
Образующиеся полимеры полифенолов содержат от 2 до 10 молекул флавоноидов. Эти вещества плохо растворимы в вине, кроме того они легко взаимодействуют с другими высокомолекулярными соединениями в вине, например, с белками и протеидами и образуют комплексы, дающие осадки или “рубашки” вина. Большое количество мономеров полимеров обычно не обнаруживается, т.к. полимер с 10 мономерами плохо расворяется в вине и выпадает в осадок.
Существует еще одно современное представление на образование полимеров:
C t(катехин) активизируется Ct*
C t* + Ct* Димер (Dm)
На трансформацию и полимеризацию полифенолов оказывают существенное влияние ОВ-реакции.
Реакции полимеризации полифенолов имеют очень важное значение. Они влияют на вкус, цвет вина. Многие мономеры имеют горький вкус, который при полимеризации снижается. Мономеры антоцианов имеют красно-фиолетовую окраску, которая в результате реакции полимеризации превращается в кирпичную.
интенсивность вкусовых ощущений 4 вкусовых ощущения

 горький
- полифенолы (окисляются, полимеризуются,
выпадают в осадок)
горький
- полифенолы (окисляются, полимеризуются,
выпадают в осадок)
кислый - кислоты (выпадают в осадок, окисляются, этерифицируются)

сладкий - сахара (вступают в реакции меланоидинообразования)
соленый - соли (Na, K -соли), (выпадают в осадок)

продолжителность выдержки
В молодом вине вкус ощущается более интенсивно. В выдержанных винах присутствуют менее интенсивные, слаженные тона.
6.5. Реакции гидролиза
При созревании вин гидролизу подвергаются полисахариды, из которых образуются моносахара; белки, полипептиды и пептиды, из которых образуются АМК; и, возможно, гликозиды, из которых образуются сахара и агликоны (вещества неуглеродной природы, обычно полифенолы).
Возможно, что гидролизу подвергаются ацилированнын пигменты, т.е. ацилированные формы антоцианов. Гидролизу подвергаются также эфиры.
Как видно из приведенных положений, процесс созревания вина характеризуется сочетанием и взаимным влиянием большого числа реакций: ОВ-реакций, этерификации, карбониламинных, полимеризации и поликонденсации и других, еще недостаточно изученных.
6.6. Химические превращения компонентов вина при созревании и старении
Превращение фенольных веществ при созревании вина
При созревании вина происходит окисление полифенолов, особенно интенсивно окисляются катехины и лейкоантоцианы. При окислении из них образуются хиноны, которые вступают в реакции полимеризации и выпадают в осадок. Вот почему после 2-3 лет выдержки в винах катехины не обнаруживаются.
Антоцианы также подвергаются полимеризации и в старых винах практически не обнаруживаются.
В результате неясно, что понимается под фенолльными веществами в старых винах. Если красные молодые вина имеют максимум поглощения при 520 нм, а минимум при 420 нм, то в старых винах максимум исчезает и спектр изменяется. Вот почему отношение 520/420 по предложению французского ученого Сидро является показателем возраста вина.
 D
D




420 520 , нм
Превращение азотистых веществ при созревании вина
Различные группы азотистых веществ при созревании и старении принимают участие в многочисленных реакциях.
Некоторые ученые отводят особо важную роль реакции окислительного дезаминирования АМК, считая, что образующиеся при этом аммиак и альдегиды придают тон окисленности в винах:
R -CHNH2-COOH + 1/2O2 R-CH=O + NH3 + CO2
По данным профессора Г.Г.Агабальянца и доцента Н.Н.Глониной реакция окислительного дезаминирования протекает при выдержке вин в незначительной степени, а тон окисленности вин вызывается свободным ацетальдегидом.
Реакция окислительного дезаминирования имеет значение при выдержке вин при повышенных температурах и термообработке.
Как показали работы, выполненные на кафедре, альдегиды при созревании вина образуются главным образом за счет окисления соответствующих спиртов.
-2H
С Н3-СН2-ОН СН3-СН=О
этанол уксусный альдегид
-2Н
( СН3)2-СН-СН2ОН (СН3)2-СН-СН=О
изобутанол изомасляный альдегид
-2H
( СН3)2-СН-СН2-СН2ОН (СН3)2-СН-СН2-СН=О
изопентанол изовалериановый альдегид
Превращения органических кислот
Органические кислоты взаимодействуют со спиртами и образуют эфиры:
R 1-CH2-COOH + HO-R2 R1-CH2-CO-O-R2 + H2O
Превращение винной кислоты
Работы Женевуа, Риберо-Гайона, Родопуло показали, что винная кислота окисляется в диоксифумаровую, далее в дикетоянтарную и щавелевую (см. раздел “ОВ-системы”).
Превращение спиртов
Спирты окисляются в альдегиды:
-2Н
R -CH2OH R-CH=O
Спирты при взаимодействии с кислотами образуют эфиры (см. раздел “Эфиры”).
Спирты при взаимодействии с альдегидами образуют ацетали:
C H3-CH=O + HO-C2H5 CH3-CHOH-O-C2H5 + HO-C2H5
полуацеталь
CH3-CH-(OC2H5)2
диэтилацеталь
Ацетали в больших количествах образуются в хересе и коньяке.
При старении вина происходят те же самые процессы, что и при созревании, только в отсутствие кислорода.
Вопросы для самоконтроля по теме:
1. В каких условиях протекает созревание и старение вина?
2. Какие процессы являются основными в формировании вкуса и букета выдержанных вин?
3. Какие катализаторы процессов окисления вы знаете? Опишите биологические и неорганические катализаторы.
4. Расскажите о необратимых и обратимых ОВ-системах.
5. Какими путями протекает реакция этерификации в вине?
6. В результате чего происходит реакция меланоидинообразования?
7. Какие продукты участвуют в реакциях полимеризации и поликонденсации?
8. Расскажите о превращении компонентов вина при созревании и старении?
Тесты по теме:
1. Созревание вина происходит:
А) В аэробных условиях; Б) В анаэробных условиях.
2. При созревании вина происходит:
А) Увеличение содержания винной кислоты; Б) Снижение содержания винной кислоты; В) Количество кислоты остается постоянным.
3. При старении вина в основном происходят:
А) Окислительные процессы; Б) Восстановительные процессы.
4. Реакция этерификации-это реакция взаимодействия:
А) Сахаров с аминокислотами; Б) Кислот с сахарами; В) Кислот со спиртом.
5. Какая кислота не вступает в реакцию этерификации?
А) Яблочная; Б) Молочная: В) Щавеливая; Г) Винная.
6. Сахароаминная реакция протекает:
А) При обработке холодом; Б) При обработке теплом.
7. Появление "керосиновых" тонов при старении вина связано с:
А) Накоплением азотистых веществ; Б) Накоплением фенольных соединений;
В) Накоплением кислот; Г) Накоплением углеводородов.
