
- •Предмет и задачи кристаллохимии.
- •Общие свойства кристаллических веществ.
- •4. Вывод уравнения Вульфа-брегга, его использование.
- •Применение
- •5. Методы рентгеновской съёмки кристаллов.
- •6. Метод Дебая-Шеррера в рса, его использование.
- •7. Рентгенофазовый анализ.
- •9. Металлическая связь. Зонная теория Брилюэна.
- •10. Основные типы структуры металлов. Общие свойства металлов.
- •Общие физические свойства
- •11. Структура неметаллов. Правило Юм-Розери. Свойства кристаллических неметаллов.
- •13. Ионная связь. Энергия кристаллической решетки.
- •14. Размеры атомов и ионов. Ионные радиусы по Тольдшмидту и Полингу. Закономерности в изменении кристаллических радиусов.
- •15.Основные типы кристалличетских структур. Примеры.
- •16. Строение солей неорганических веществ. Структурные единицы.
- •17. Строение перовскита. Сегнетоэлектрики.
- •18. Строение шпинели. Ферромагнетики.
- •19. Строение и свойства силикатов. Цеолиты
- •20. Полиморфизм. Различие в строение полиморфных модификаций.
- •21. Изоморфизм. Твердые растворы замещения, твердые растворы внедрения.
- •22. Интерметаллические соединения: твердые растворы замещения, фазы Лавеса, внедрения, соединения Юм-Розери, «ионные» соедения.
- •24. Реальные кристаллы. Дефекты кристаллических решеток.
- •25. Физические свойства кристаллических веществ. Оптические свойства. Пьезоэлектрики. Влияние симметрии кристалла на его физические свойства.
- •26. Классификация кристаллических структур.
16. Строение солей неорганических веществ. Структурные единицы.
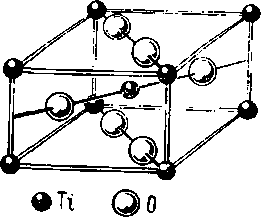
Рис. 172. Структурный тип рутила TiO2
по узлам гранецентрированной кубической решетки, атомы (ионы) фтора — в центрах каждого октанта. Координационное число атомов кальция —8, координационный многогранник — куб; координационное число атомов фтора —4, координационный многогранник — тетраэдр. Координационные числа в структурном типе CaF2 сокращенно записываются (8,4). Федоровская группа симметрии Fm3m. В этом структурном типе кристаллизуется много различных по составу веществ. Окислы и сульфиды щелочных металлов — Li2O, Na2O, Na2S и др.— имеют аналогичную структуру, но места, занимаемые в структуре CaF2 катионами, в этих структурах занимают анионы, и наоборот. Такие пары структурных типов часто называют антиизоморфными.
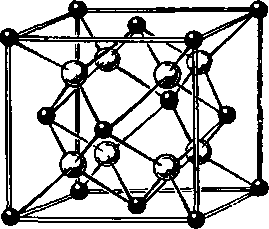
Рис. 171. Структурный тип флюорита CaF2
CaF2 модификации ТiО2. Атомы титана расположены по вершинам и в центре ячейки, атомы кислорода — по одной из диагоналей базисных граней ячейки и по перпендикулярной к ней диагонали в плоскости, параллельной базису и проходящей через центр ячейки. Координационное число (6,3). Координационные многогранники — октаэдр и треугольник.
Примером структурных типов с координационными числами (4,2) могут служить многочисленные кристаллические модификации SiO2. Опишем наиболее симметричную из них — тип кристобалита.
(рис. 173). Атомы кремния располагаются в кубической ячейке так же, как атомы углерода в структуре алмаза. В промежутке между каждой парой ближайших атомов кремния находится атом кислорода. Координационный многогранник у кремния — тетраэдр, у кислорода — гантель.
Далее рассмотрим структурный тип СО 2 (рис. 174). Кристаллическая двуокись углерода имеет кубическую решетку, атомы углерода в которой занимают узлы гранецентрированной ячейки. Атомы кислорода образуют гантель, в середине которой расположен атом углерода. Координационные числа (2,1). Если разбить ячейку на 8 малых кубов и в каждом малом кубе выбрать по одной пространственной диагонали (по одной тройной оси) так, чтобы эти диагонали при продолжении до бесконечности не пересекали бы друг друга (см. рис. 175), то мы получим представление о направлении молекул O = C= = O в кристалле. Этот тип (мотив) расположения материальных частиц удлиненной формы встречается во многих структурных типах. Кратко мы будем его называть «расположением по четырем тройным непересекающимся осям».
Структуры, подобные CO2, в которых можно выделить отдельные молекулы, носят название молекулярных структур.
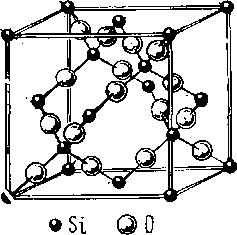
Рис. 173. Структурный тип кристобалита
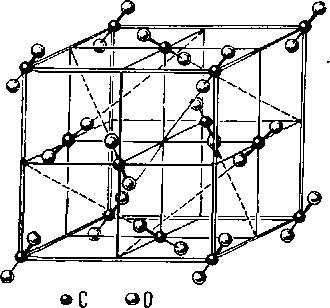
Рис. 174. Структурный тип двуокиси углерода СО2.
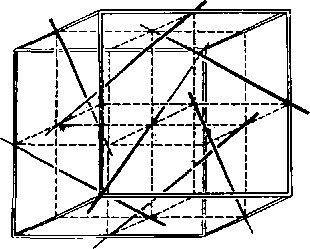
Рис. 175. Кубическая ячейка с четырьмя тройными непересекающимися друг с другом осями симметрии третьего порядка

Рис. 176. Структурный тип пирита FeS2
Геометрически весьма сходна со структурой CO2 структура пирита FeS2 (рис. 176). Как было сказано выше, ячейку гранецентрированной кубической решетки (равно как и соответствующую ей правильную систему точек) можно рассматривать в различных аспектах. На рис. 177 показана гранецентрированная ячейка в трех аспектах. В случае (а) исходная точка правильной системы помещена в начало координат и имеет координаты (000); в случае (б) такого совпадения нет; в случае (в) координаты исходной точки (1A 1A 1A).
