
- •Коррозия металлов. Общие положения.
- •Какие сопротивления оказывают существенное влияние на кинетику электрохимической коррозии?
- •Какими приемами можно сместить потенциал металла в положительную сторону?
- •Какими уравнениями описывается кинетика высокотемпературного окисления металлов?
- •Какова роль окислителей при переходе металла в оксидное состояние?
- •Кинетика роста оксидных пленок при высокотемпературном окислении металлов?
- •Особенности процесса химической коррозии металлов.
- •Особенности процесса электрохимической коррозии металлов.
- •Перечислите внешние факторы, оказывающие существенное влияние на кинетику электрохимической коррозии.
- •Показатели коррозионной стойкости металлов и методы их оценки.
- •Полная кривая анодной поляризации для пассивирующихся металлов.
- •Термодинамическое условие возникновения электрохимической коррозии.
- •Термодинамическое условие высокотемпературного окисления металлов.
- •Что понимается под жаростойкостью и жаропрочностью металлов?
- •Что такое катодная поляризация и чем она вызывается?
- •Защита металлов и сплавов.
- •Коррозия металлов и сплавов
- •Коррозионная характеристика благородных металлов. В каких условиях они могут корродировать?
- •Коррозионная характеристика сплава 03хн28мдт.
- •Коррозионная характеристика сплавов на железно-никелевой основе.
- •Коррозионная характеристика сплавов системы железо-углерод.
- •Коррозионная характеристика сталей с пониженным содержанием никеля (экономно-легированных сталей). Приведите примеры.
- •Коррозионная характеристика титана и его сплавов.
- •Коррозионная характеристика цинка и кадмия. Для каких целей они используются.
- •Коррозионная характеристика цинка.
- •Кривая зависимости коррозионной стойкости железа от скорости движения нейтральной среды.
- •Причины возникновения межкристаллитной коррозии хромистых и хромоникелевых сталей.
- •Состав сплавов типа монелей и хастеллоев. В каких средах они устойчивы?
- •Состав сплавов типа нихром.
- •Химическая стойкость хрома.
- •Чем вызывается питтинговая коррозия хромоникелевых сталей?
- •Коррозия неметаллических соединений
- •В чем различие термопластов от реактопластов?
- •Виды силикатных материалов, применяемых в антикоррозионной технике.
- •Влияние окислительной среды на стойкость полимеров.
- •Для каких целей служит полиизобутилен? в каких средах он стоек? До каких температур его можно применять?
- •Для чего пропитывают графит синтетическими смолами?
- •Как заделать небольшой скол силикатной эмали в аппарате?
- •Как обеспечивается непроницаемость футеровок из силикатных материалов?
- •Методы гуммировки химической аппаратуры.
- •Силикатные материалы, получаемые методом спекания.
- •Состав кислотоупорного цемента.
- •Состав полимерсиликатного бетона и области его применения.
- •Способы ремонта покрытий из силикатных эмалей.
- •Что такое текстолит? в каких средах он стоек?
- •Что такое текстофаолит? в каких средах он стоек?
Коррозия металлов. Общие положения.
В каких средах имеет место локальное нарушение пассивности?
В СИЛЬНО ОКИСЛИТЕЛЬНЫХ СРЕДАХ
В чем различие между электрохимической и химической коррозией?
В хим корр взаимодействие Ме с корр средой: окисление Ме и восст-е окисл-го комп-та среды протекают в одном акте. А в эл-хим корр нет и скорость процесса зависит от величины электродных потенциалов.
Виды коррозионного разрушения металлов.
Сплошная (равномерн, неравномерн, избират) и местная или локальная (пятнами, язвенная, точечная (питтинг), сквозная, межкристаллитная, подповерхностная, ножевая)
Вследствие каких причин термодинамически неустойчивые металлы в реальных условиях становятся стойкими против коррозии?
Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
Введение в стальной сплав хрома, титана, марганца, никеля и меди позволяет получить легированную сталь с высокими антикоррозийными свойствами. Особенную стойкость стальному сплаву придает большая доля хрома, благодаря которому на поверхности конструкций образуется оксидная пленка большой плотности. Введение в состав низколегированных и углеродистых сталей меди (от 0,2% до 0,5%) позволяет повысить их коррозийную устойчивость в 1,5-2 раза.
Движущая сила процесса электрохимической коррозии.
Разность между равновесными потенциалами катодной и анодной реакции.
Для каких целей используется уравнение Нернста?
При достижении равновесия значение потенциала Ме становится постоянным, а его величина зависит от внешних условий - Т, Р - и активности ионов Ме в растворе и описывается уравнением Нернста: φМ = φ0м + (R*T/n*F)ln aм n+
Изобразите кривую зависимости коррозионной стойкости железа от скорости движения нейтральной среды.
Величина рН растворов оказывает очень незначительное влияние на скорость коррозии, поэтому коррозия Ме в нейтр среде в основном зависит от ее состава.
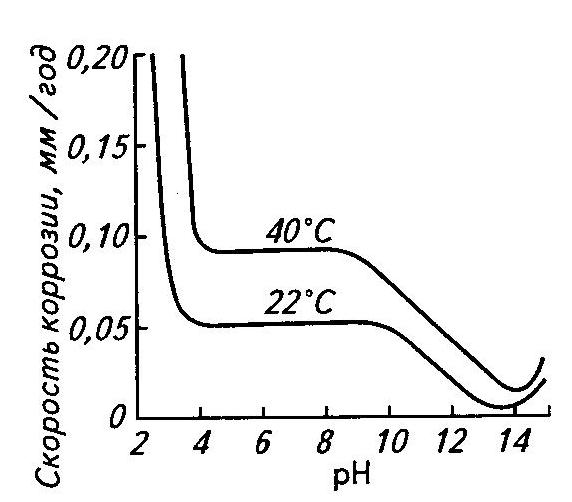
Как влияет рН раствора на коррозию металлов?
Оказывает влияние на перенапряжение водорода - в кислых ср увел рН прив к росту перенапряж водорода, а в щелочн наоборот; влияет на образ и св-ва пленко продуктов корр.
Как влияет температура на скорость коррозии металлов при восстановлении кислорода?
Скорость коррозионных процессов, при значительном повышении температуры понижается вследствие уменьшения растворимости кислорода. Повышение температуры иногда приводит к пассивированию металла.
Как перевести металл в пассивное состояние?
При смещении потенциала пов-ти Ме в положит сторону на металлич пов-ти образуется оксидн пленка, кот переводит Ме в пассивное состояние.
Как повлияет увеличение перенапряжения водорода на скорость коррозии металла, находящегося в пассивном состоянии?
СКОРОСТЬ УМЕНЬШИТСЯ
Какие металлы подвержены водородной коррозии? Как ее предотвратить?
Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии.Медь и медные сплавы подвержены водородной коррозии. Это явление связано с восстановлением закиси меди Cu2О, которая входит в виде включений в состав многих медных сплавов:
Cu2О + Н2 = Н2О + 2Cu
Образующиеся пары воды создают внутри металла высокое давление, что приводит к возникновению трещин и потере пластичности. Мерой борьбы против этого явления является снижение содержания закиси меди в сплавах. При концентрации Cu2О не более 0,01 % явления водородной коррозии не наблюдается.
