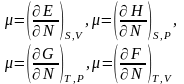- •1, Ньютонова форма уравн механики
- •3. Гамильтонова форма представления
- •2.Лагранжева форма уравн механики
- •11. Типы термодинамических систем и процессов. Первое начало термодинамики. Работа. Количество теплоты. Внутренняя энергия.
- •12. Второе начало термодинамики. Цикл Карно. Второе начало термодинамики в формулировке Клаузиуса и Кельвина. Круговые процессы. Тепловые машины. Теоремы Карно.
- •13. Энтропия. Энтропия идеального газа. Закон возрастания энтропии. Статистическое истолкование второго начала термодинамики. Теорема Нернста (третье начало термодинамики).
- •14.Термодинамические потенциалы закрытых и открытых термодинамических систем. Понятие обобщенных термодинамических координат и сил.
- •15. Статистические распределения (микроканоническое, каноческое и большое каноническое), их физический смысл и использование для нахождения термодинамических параметров.
- •16. Идеальный квантовый Ферми-газ. Распределение ферми-Дирака. Вырожденный электронный газ. Поверхность.
- •19. Фазовые превращения. Фазовые диаграммы. Уравнения Клапейрона-Клаузиуса.
- •17. Идеальный квантовый Бозе-газ. Распределение Бозе-Эйнштейна. Квантовая статистика фотонов и фононов, их термодинамические величины и уравнения состояния.
- •18. Неидеальный газ. Уравнение Ван-дер-Ваальса.
- •22. Электрический заряд. Закон Кулона. Электрическое поле. Потенциальность электрического поля
- •24. Стационарное магнитное поле. Закон Био-Савара-Лапласа. Закон Ампера. Сила Лоренца.
- •23. Электрическое поле в проводниках и диэлектриках. Энергия электрического поля.
- •25. Вихревой характер магнитного поля. Энергия магнитного поля. Магнитные свойства вещества.
- •26. Электрический ток. Уравнение непрерывности. Законы постоянного тока. Проводимость различных сред. Критерий квазистационарности.
- •27. Электромагнитное поле. Явление электромагнитной индукции. Вихревое электрическое поле и токи смещения
- •29. Основы специальной теории относительности.
- •30. Электромагнитные волны. Волновые уравнения и их решения. Плоская электромагнитная волна, её свойства и характеристики. Перенос энергии электромагнитными волнами.
- •20. Фазовые переходы первого и второго рода (поведения термодинамическое потенциалов и производных от них)
- •33. Интерференция света. Когерентность. Способы получения когерентных волн. Интерференция многих волн. Интерферометрия.
- •34. Дифракция света. Принцип Гюйгенса-Френеля. Дифракция Френеля и Фраунгофера. Дифракционная решётка. Физические основы голографии.
- •35. Поляризация света. Основные виды поляризации. Получение и преобразование поляризованного света. Поляризационные приборы
- •4)Призма Аренса.
- •37. Геометрическая оптика. Принцип Ферма. Центрированная оптическая система. Простейшие оптические приборы.
- •38. Принцип работы лазера и свойств лазерного излучения. Основы нелинейной оптики
- •39. Корпускулярно-волновой дуализм. Фотоны. Фотоэффект. Опыты Франка-Герца. Волны де Бройля. Дифракция микрочастиц. Связь между корпускулярными и волновыми свойствами
- •21. Флуктуации термодинамических величин. Распределения Гаусса. Корреляции основных термодинамических величин.
- •40.Квантование энергии атомов. Постулаты Бора. Модель атома Бора.
- •41. Атом водорода. Волновые функции и уровни энергии. Квантовые числа.
- •43.Атом во внешних полях. Эффект Зеемана. Эффект Штарка.
- •42.Строение сложных атомов. Принцип Паули и электронные оболочки. Физическое объяснение периодического з-на.
- •36. Распространение света в среде. Дисперсия и поглощение. Рассеяние света.
- •45.Принцип суперпозиции состояний в кв.Мех. Решение уравнения Шредингера для линейного осциллятора
- •48. Интегралы движения в кв. Мех. Элементы теории представлений.
- •46.Принцип причинности в кв. Мех. Временное уравнение Шредингера. Стационарные состояния.
- •47.Одновременное определение физ. В-н. Соотношение неопределенностей.
- •49.Квант переходы.Вероятности переходов.
- •50.Уравнение Дирака.
- •51.Общая характеристика атомных ядер.
- •52.Энергия связи ядра.
- •53.Явление радиоактивности.
- •57. Стандартная модель
- •54.Ядерные реакции
- •56.Фундаментальные взаимодействия.
13. Энтропия. Энтропия идеального газа. Закон возрастания энтропии. Статистическое истолкование второго начала термодинамики. Теорема Нернста (третье начало термодинамики).
Энтропия мера обесценивания энергии. Энтропия – мера беспорядка (хаоса) в т/д с-ме. Энтропия – число возможных микросост-й. все процессы в природе идут от менее вероятных к более вероятным. Энтропия мера вероятности сост-я т/д с-мы.
Так
м/перейти к парадоксу , кот-й наз-тся
тепловая смерть вселенной. Если
предполож-ть, что вся Вселенная изолир-я
с-ма, то энтропия д/ стремиться к макс-му.
Но этого не происх-т. Почему? Попробуем
получить з-н возр-ния энтропии. Выясним
чему равно
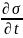 .
S=kσ
– энерг-кая энтропия [S]=[k]=Дж/к.
Пусть есть 2а сост-я с-мы. С-мы переходит.
Энтропия – вел-на дающая хар-ку вел-н
потерь инф-ции при переходе от
макроописаний к микроописаниям.
Объёденим все 3 опред-ния и получим II
начало т/д в энтропийной формулировке:
все процессы, происход-щие в изолированных
т/д с-мах идут с увилич-ем энтропии (т.е.
увилич-ся вер-ть, т.е. наиб-е вероятное
сост-е с т/д с-мы – это сост-е с наибольшим
хаосом, при кот-й эн-гия полностью
обесценивается. Если с-ма чётко нах-ся
в главном квант-м сост-и, то её энтропия
=0. Рассм-м кв-ю с-му в квазизам-м сост-и,
когда E нах-тся в интервале E→E+δE.
Посчитаем энтропию
.
S=kσ
– энерг-кая энтропия [S]=[k]=Дж/к.
Пусть есть 2а сост-я с-мы. С-мы переходит.
Энтропия – вел-на дающая хар-ку вел-н
потерь инф-ции при переходе от
макроописаний к микроописаниям.
Объёденим все 3 опред-ния и получим II
начало т/д в энтропийной формулировке:
все процессы, происход-щие в изолированных
т/д с-мах идут с увилич-ем энтропии (т.е.
увилич-ся вер-ть, т.е. наиб-е вероятное
сост-е с т/д с-мы – это сост-е с наибольшим
хаосом, при кот-й эн-гия полностью
обесценивается. Если с-ма чётко нах-ся
в главном квант-м сост-и, то её энтропия
=0. Рассм-м кв-ю с-му в квазизам-м сост-и,
когда E нах-тся в интервале E→E+δE.
Посчитаем энтропию
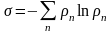 .есть
равновесное тело сост-е, кот-го зад-тся
2мя макропараметрами T иV. Пусть V
поддерж-ем const. Если T мен-тся, то
теплоёмкость тела
.есть
равновесное тело сост-е, кот-го зад-тся
2мя макропараметрами T иV. Пусть V
поддерж-ем const. Если T мен-тся, то
теплоёмкость тела
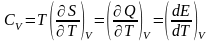 ,
т.к dE=TdS-pdV, dE=dQ. Что будет происходить с
теплоёмкостью при понижении тем-ры до
0. Т.к.
,
т.к dE=TdS-pdV, dE=dQ. Что будет происходить с
теплоёмкостью при понижении тем-ры до
0. Т.к.
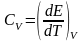 ,
то всё зависит от dE и того как внутр-я
энергия ведёт себя при понижении T.
Внутр-я энергия с умен-ем тем-ры тоже
изм-тся за счёт уменьшения кин-кой
эн-гии молекул. Т.е.тепловые дв-ния
«вымораживаются» и при 0К остаются
только потенц-я эн-гия сост-е с-мы при
0К наз-тся основным сост-ем. Эн-гия Е0
– энергия основного сост-я. Любое др-гое
сост-е при Т>0К наз-тся возбуждённым
сост-ем. Е – эн-гия возб-го сост-я. Помимо
теплоёмкости
,
то всё зависит от dE и того как внутр-я
энергия ведёт себя при понижении T.
Внутр-я энергия с умен-ем тем-ры тоже
изм-тся за счёт уменьшения кин-кой
эн-гии молекул. Т.е.тепловые дв-ния
«вымораживаются» и при 0К остаются
только потенц-я эн-гия сост-е с-мы при
0К наз-тся основным сост-ем. Эн-гия Е0
– энергия основного сост-я. Любое др-гое
сост-е при Т>0К наз-тся возбуждённым
сост-ем. Е – эн-гия возб-го сост-я. Помимо
теплоёмкости
 ,
,
 ,
где p
и V
это макропараметры хар-щие сост-е с-мы
м/ввести ряд др-х макропараметров: ч-о
ч-ц N, напряж-ть эл.п., напряж-ть магн-го
поля, поэтому все они могут обозначаться
одним символом a
Можно ввести много других видов
теплоёмкости отв-х за каждый макропараметр:
,
где p
и V
это макропараметры хар-щие сост-е с-мы
м/ввести ряд др-х макропараметров: ч-о
ч-ц N, напряж-ть эл.п., напряж-ть магн-го
поля, поэтому все они могут обозначаться
одним символом a
Можно ввести много других видов
теплоёмкости отв-х за каждый макропараметр:
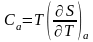 при
тем-ре стемящ-ся к 0 Сазав-т
от энтропии, но S=S(T,a). Но при тем-ре →0,
S→0. Что происходит при 0К мы точно
сказать мы м/только постулировать, что
различ-е теплоёмкости при пониж-итем-ры,
→ к одному и тому же пределу. Иначе: Th
нернста: энтропия любой с-мы в основном
сост-и не зависит ни от каких внеш.
Параметров и одинакова для всех тел.
Иначе
при
тем-ре стемящ-ся к 0 Сазав-т
от энтропии, но S=S(T,a). Но при тем-ре →0,
S→0. Что происходит при 0К мы точно
сказать мы м/только постулировать, что
различ-е теплоёмкости при пониж-итем-ры,
→ к одному и тому же пределу. Иначе: Th
нернста: энтропия любой с-мы в основном
сост-и не зависит ни от каких внеш.
Параметров и одинакова для всех тел.
Иначе
 .
В основном предполагаем, что энтропия
основного сост-я =0, но это не док-тся.
Th
Нернста часто формулир-тся как
невозможность достиж-я абсолют-го 0.
.
В основном предполагаем, что энтропия
основного сост-я =0, но это не док-тся.
Th
Нернста часто формулир-тся как
невозможность достиж-я абсолют-го 0.
14.Термодинамические потенциалы закрытых и открытых термодинамических систем. Понятие обобщенных термодинамических координат и сил.
Если
λ
внешнее поле, то все параметры внеш.
поля можно объединить одним названием-
λ-обобщённые
сопряжённые координаты. Лi=
-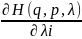 -обобщённая
сопряжённая сила. dRi=Лidλi
–
работа над системой какой-то i-й
сопряжённой силы Если над системой
действуют многие поля, тогда изменение
внутренней эн.dE=TdS-PdV+∑
Лidλi.
Термодин. потенциал-функция состояния
термодин.систем. Внутр.энергия
dE=TdS-PdV-1-е
нач.термод-ки.Соотношение Максвелла
для потенциала внутренней энергии:
-обобщённая
сопряжённая сила. dRi=Лidλi
–
работа над системой какой-то i-й
сопряжённой силы Если над системой
действуют многие поля, тогда изменение
внутренней эн.dE=TdS-PdV+∑
Лidλi.
Термодин. потенциал-функция состояния
термодин.систем. Внутр.энергия
dE=TdS-PdV-1-е
нач.термод-ки.Соотношение Максвелла
для потенциала внутренней энергии: .
.
Энтальпия (тепловая ф-ия) dH=TdS+VdP(H=E+PV).
Смысл: ф-ция теплосодержания в термодин. Системе:
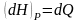 .
.

Соотношение
Максвелла:
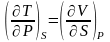
Свободная
энергия Гельмгольца dF=-SdT-PdV(F=E-TS).
Смысл:
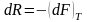 -работа,
кот.совер-т термод.сис-ма идёт за счёт
уменьшения её свободн.энергии Гел-ца
при изотерм.процессе.
-работа,
кот.совер-т термод.сис-ма идёт за счёт
уменьшения её свободн.энергии Гел-ца
при изотерм.процессе.
Соотношение
Максвелла:
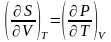
Свободн.
энергия Гиббса dG=-SdT+VdP(G=F+PV).
Смысл: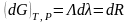 -работа
сил немеханическ.природы идёт на
увеличение потен-ла Гиббса термодин.сис-мы
при изотерма-изобарных процессах.Соотношение
Максвелла:
-работа
сил немеханическ.природы идёт на
увеличение потен-ла Гиббса термодин.сис-мы
при изотерма-изобарных процессах.Соотношение
Максвелла:
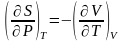 .Зная
любой такой термодин. потен-л можем
найти из него любой другой потен-л.
.Зная
любой такой термодин. потен-л можем
найти из него любой другой потен-л.
Термодин. пот-лы открытых термодин. систем:
N-число частиц,μ-хим.потенциал, μdN-хим.работа,кот.совершается над сис-ой при изменении числа частиц в ней на dN(диффузия).
dE=TdS-PdV+μdN; dH=TdS+VdP+ μdN; dF=-SdT-PdV+ μdN; dG=-SdT+VdP+ μdN
Удел.
энтропия:
 .
Удел. объём:
.
Удел. объём: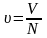 .
Удел. внутренняя энергия:
.
Удел. внутренняя энергия: .
Приращение потенциала Гибса:
.
Приращение потенциала Гибса:

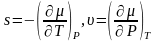
Открытая
сис-ма-сис-ма в кот.число частиц
меняется.N-играет
роль обобщённых сопряжённых
координат,μ-сопряжён.обобщён.силы,кот.появляются
в ответ на изменение частиц.Зная
зависимость каждого термод.потен-ла
от числа частиц можно опред-ть хим.
потен-л при различных внеш. параметрах.