
- •1. Круговые процессы (циклы)
- •2. Кпд кругового процесса. Обратимые и необратимые процессы.
- •3. Второе начало термодинамики.
- •4. Тепловые и холодильные машины.
- •5. Цикл Карно
- •6. Кпд цикла Карно для идеального газа.
- •7. Приведенное количество тепла. Неравенство Клаузиуса.
- •8. Энтропия
- •9. Свойства энтропии
- •10. Изменение энтропии при различных процессах.
- •11. Энтропия и вероятность.
- •12. Отклонение газов от идеальности
- •15. Физический смысл поправки a/ .
- •16. Уравнение Ван-дер-Вальса для произвольной массы газа.
- •17. Изотермы Ван-дер-Вальса
- •18. Значение объёма, давления и температуры в критической точке.
- •23. Внутренняя энергия реального газа
- •19.Эксперементальные изотермы.
- •20. Анализ горизонтального участка экспериментальной изотермы Ван-дер-Вальса.
- •25. Эффект Джоуля-Томсона. Энтальпия.
- •27. Сжижение газов
- •28.Свойства жидкостей
- •29. Поверхностное натяжение.
- •30. Смачивание
- •31. Давление под изогнутой поверхностью жидкости.
- •32. Капиллярные явления.
15. Физический смысл поправки a/ .
Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
![]()
где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, Vm — молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
16. Уравнение Ван-дер-Вальса для произвольной массы газа.
Для произвольного количества вещества v газа (v=m/M) с учетом того, что V=vVm, уравнение Ван-дер-Ваальса примет вид
![]()
где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
17. Изотермы Ван-дер-Вальса
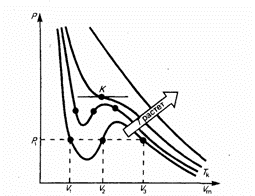

18. Значение объёма, давления и температуры в критической точке.
Для нахождения критических параметров подставим их значения в уравнение запишем
![]()
(символ «m» для простоты опускаем). Поскольку в критической точке все три корня совпадают и равны Vк уравнение приводится к виду
![]()
или
![]()
Tax как уравнения тождественны, то в них должны быть равны и коэффициенты при неизвестных соответствующих степеней. Поэтому можно записать
![]()
Решая полученные уравнения, найдем
![]()
23. Внутренняя энергия реального газа
Внутренняя
энергия реального газа включает в себя
не только кинетическую энергию движения
молекул, но и потенциальную энергию их
взаимодействия (притяжения) на расстоянии.
Действие этих сил приводит к уменьшению
давления на величину
![]() . При расширении реального газа должна
быть совершена работа против межмолекулярных
сил, равная приращению потенциальной
энергии молекул
. При расширении реального газа должна
быть совершена работа против межмолекулярных
сил, равная приращению потенциальной
энергии молекул
![]()
Интегрирование
этого равенства дает следующее выражение
для потенциальной энергии ![]() .
.
При
возрастании объема до бесконечности
газ должен становиться идеальным и
потенциальная энергия его молекул
должна стремиться к нулю. Поэтому
постоянную интегрирования нужно положить
равной нулю. Тогда внутренняя энергия
одного моля реального газа равна
![]()
19.Эксперементальные изотермы.
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая, ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму р, Vm под изотермой на три области:
под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар),
слева от нее находится область жидкого состояния,
а справа — область пара.
20. Анализ горизонтального участка экспериментальной изотермы Ван-дер-Вальса.
Рассматривая
различные участки изотермы при
Т<Тк
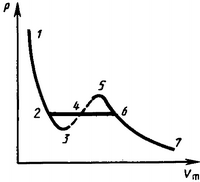 ,
видим,
что на участках 1—3 и 5—7 при уменьшении
объема Vm давление
р возрастает, что естественно. На участке
3—5 сжатие вещества приводит к уменьшению
давления; практика же показывает, что
такие состояния в природе не осуществляются.
Наличие участка 3—5 означает, что при
постепенном изменении объема вещество
не может оставаться все время в виде
однородной среды; в некоторый момент
должно наступить скачкообразное
изменение состояния и распад вещества
на две фазы. Таким образом, истинная
изотерма будет иметь вид ломаной линии
7—6—2—1.
Часть 7—6 отвечает газообразному
состоянию, а часть 2—1 — жидкому. В
состояниях, соответствующих горизонтальному
участку изотермы 6—2, наблюдается
равновесие жидкой и газообразной фаз
вещества. Вещество в газообразном
состоянии при температуре ниже критической
называется паром, а пар, находящийся в
равновесии со своей жидкостью,
называется насыщенным.
,
видим,
что на участках 1—3 и 5—7 при уменьшении
объема Vm давление
р возрастает, что естественно. На участке
3—5 сжатие вещества приводит к уменьшению
давления; практика же показывает, что
такие состояния в природе не осуществляются.
Наличие участка 3—5 означает, что при
постепенном изменении объема вещество
не может оставаться все время в виде
однородной среды; в некоторый момент
должно наступить скачкообразное
изменение состояния и распад вещества
на две фазы. Таким образом, истинная
изотерма будет иметь вид ломаной линии
7—6—2—1.
Часть 7—6 отвечает газообразному
состоянию, а часть 2—1 — жидкому. В
состояниях, соответствующих горизонтальному
участку изотермы 6—2, наблюдается
равновесие жидкой и газообразной фаз
вещества. Вещество в газообразном
состоянии при температуре ниже критической
называется паром, а пар, находящийся в
равновесии со своей жидкостью,
называется насыщенным.
