
- •1. Круговые процессы (циклы)
- •2. Кпд кругового процесса. Обратимые и необратимые процессы.
- •3. Второе начало термодинамики.
- •4. Тепловые и холодильные машины.
- •5. Цикл Карно
- •6. Кпд цикла Карно для идеального газа.
- •7. Приведенное количество тепла. Неравенство Клаузиуса.
- •8. Энтропия
- •9. Свойства энтропии
- •10. Изменение энтропии при различных процессах.
- •11. Энтропия и вероятность.
- •12. Отклонение газов от идеальности
- •15. Физический смысл поправки a/ .
- •16. Уравнение Ван-дер-Вальса для произвольной массы газа.
- •17. Изотермы Ван-дер-Вальса
- •18. Значение объёма, давления и температуры в критической точке.
- •23. Внутренняя энергия реального газа
- •19.Эксперементальные изотермы.
- •20. Анализ горизонтального участка экспериментальной изотермы Ван-дер-Вальса.
- •25. Эффект Джоуля-Томсона. Энтальпия.
- •27. Сжижение газов
- •28.Свойства жидкостей
- •29. Поверхностное натяжение.
- •30. Смачивание
- •31. Давление под изогнутой поверхностью жидкости.
- •32. Капиллярные явления.
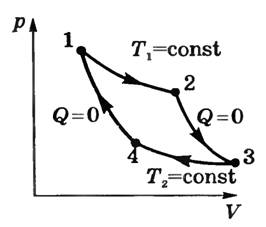
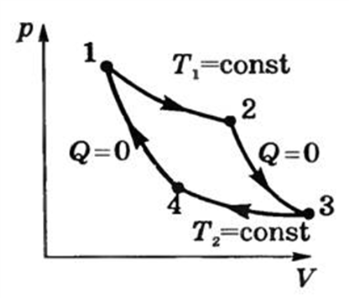
5. Цикл Карно
Можно показать, что обратимый цикл, совершаемый системой, вступающей в теплообмен с двумя тепловыми резервуарами бесконечно большой теплоемкости, может состоять только из двух изотерм и двух адиабат.
процесс 1-2 — изотермическое расширение при температуре T1;
процесс 2-3 — адиабатное расширение с понижением температуры до T2;
процесс 3-4 — изотермическое сжатие при температуре T2;
процесс 4-1 — адиабатное сжатие с повышением температуры до T1.
6. Кпд цикла Карно для идеального газа.
Н а
участке 1-2 (изотерма T1)
система получает от нагревателя
количество тепла
а
участке 1-2 (изотерма T1)
система получает от нагревателя
количество тепла
*замена v=m/м*
а на участке 3-4 (изотерма T2) система отдает холодильнику количество тепла
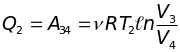
К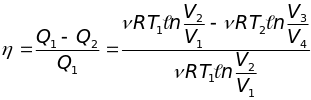 оэффициент
полезного действия равен
оэффициент
полезного действия равен
З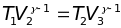 апишем
уравнение адиабатического процесса в
координатах T и V для участков
цикла Карно 2-1 и 3-4
апишем
уравнение адиабатического процесса в
координатах T и V для участков
цикла Карно 2-1 и 3-4
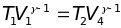
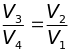
Р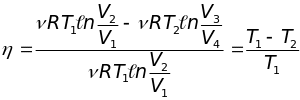 азделив
первое уравнение на второе, получим:
. Тогда
азделив
первое уравнение на второе, получим:
. Тогда
7. Приведенное количество тепла. Неравенство Клаузиуса.


8. Энтропия
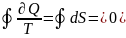
Таким
образом, для равновесных процессов
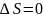 т.е.
т.е.
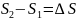
В термодинамике доказывается, что энтропия системы, совершающий необратимый цикл возрастает.
Выражения
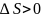 и
справедливы только для изолированных
систем, если система взаимодействует
с внешней средой, то её энтропия может
вести себя любым образом
и
справедливы только для изолированных
систем, если система взаимодействует
с внешней средой, то её энтропия может
вести себя любым образом
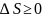 .
Это означает, что энтропия замкнутой
системы может либо возрастать, либо
оставаться неизменной для обратимых
процессов.
.
Это означает, что энтропия замкнутой
системы может либо возрастать, либо
оставаться неизменной для обратимых
процессов.
9. Свойства энтропии
Энтропия обладает свойствами аддитивности т.е. энтропия системы равна сумме энтропий тел входящих в систему. Энтропия положительна и монотонна.
10. Изменение энтропии при различных процессах.
Пусть система переходит из состояния 1 в состояние 2, тогда
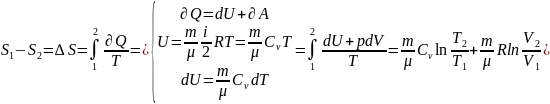
Из этого видно что изменение энтропии не зависит от вида перехода из состояния 1 в состояние 2.
В
изотермическом процессе (T=const)
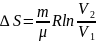
В
изохорном (V=const)
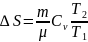
В
адиабатном
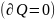 ;
S=const.
Адиабатический называется изоэнтропийным
процессом.
;
S=const.
Адиабатический называется изоэнтропийным
процессом.
11. Энтропия и вероятность.
Из теории вероятности следует, что любая система предоставленная сама себе переходит из менее вероятных состояний в более вероятное, попав в наиболее вероятное состояние она пребывает в нем бесконечно долго.
Больцман
установил, что энтропия имеет следующий
статистический смысл
![]() , где k – постоянная Больцмана, W –
термодинамическая вероятность состояния
системы – число способов реализации
данного состояния системы.
, где k – постоянная Больцмана, W –
термодинамическая вероятность состояния
системы – число способов реализации
данного состояния системы.
12. Отклонение газов от идеальности
Поведение реальных газов довольно хорошо описывается уравнением состояния идеального газа
![]()
лишь при не слишком больших давлениях и достаточно высоких температурах. При увеличении давления газа и уменьшением температуры наблюдается отклонение от уравнения состояния идеального газа. Например при давлении 1000 атмосфер азот имеет отклонение 100%.
С ростом давления увеличивается плотность газа, расстояние между молекулами уменьшается, поэтому объем молекул и взаимодействие между ними на расстоянии начинают играть существенную роль.
14. Уравнение Ван-дер-Вальса для одного моля газа. Физический смысл константы b.
для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона — Менделеева (42.4) pVm=RT (для моля газа), описывающее идеальный газ, для реальных газов непригодны.
![]()
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm, а Vm — b, где b — объем, занимаемый самими молекулами.
Объем b равен учетверенному собственному объему молекул. Для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
