
- •Глава 2
- •§1 Основные математические понятия.
- •§2 Макроскопические и микроскопические системы. Постулат равновероятности. Эргодическая гипотеза. Статистический вес. Флуктуации.
- •§3 Распределение Больцмана.
- •§4 Распределение Максвелла.
- •§5 Основное уравнение молекулярно-кинетической теории идеальных газов.
- •§6 Функция Больцмана
- •§7 Распределение энергии по степеням свободы.
- •§8 Статистики Ферми-Дирака и Бозе-Эйнштейна.
- •Глава 3. Процессы переноса.
- •§1 Длина свободного пробега, среднее число столкновений.
- •§2 Явления переноса.
- •§3 Молекулярная теория явлений переноса в газах.
- •Глава 4. Реальные жидкости и газы.
- •§1 Силы и потенциальная энергия межмолекулярного взаимодействия.
- •§2. Уравнение Ван-дер-Ваальса
- •§ 3. Изотермы Ван-дер-Ваальса и их анализ.
- •Часть 7—6 — отвечает газообразному состоянию;
- •Часть 2—1 — жидкому;
- •Часть 6—2, — горизонтальный участок, соответствующий равновесию жидкой и газообразной фаз вещества.
- •§ 4. Внутренняя энергия реального газа
- •§ 5. Свойства жидкостей. Поверхностное натяжение
- •§ 6. Смачивание
- •§ 7. Давление под искривленной поверхностью жидкости
- •§ 8. Капиллярные явления
- •§ 9. Испарение, сублимация, плавление и кристаллизация. Аморфные тела
- •§10. Фазовые переходы I и II рода
- •§ 11. Диаграмма состояния. Тройная точка
Часть 7—6 — отвечает газообразному состоянию;
Часть 2—1 — жидкому;
Часть 6—2, — горизонтальный участок, соответствующий равновесию жидкой и газообразной фаз вещества.
Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Данные выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами ирландского ученого Т. Эндрюса (1813—1885), изучавшего изотермическое сжатие углекислого газа. Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм заключается в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные.
Для нахождения критических параметров подставим их значения в уравнение (3.1) и запишем для одного моля:
 (3.2)
(3.2)
Поскольку в критической точке все три корня совпадают и равны , уравнение приводится к виду
 ,
или
,
или
 .
(3.3)
.
(3.3)
Так как уравнения (3.2) и (3.3) тождественны, то в них должны быть равны и коэффициенты при неизвестных соответствующих степеней. Поэтому можно записать:
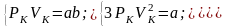 Решая
полученную систему уравнений, найдем:
Решая
полученную систему уравнений, найдем:
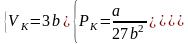 .
(4)
.
(4)
Если
решить систему относительно постоянных
величин
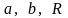 ,
получаем:
,
получаем:
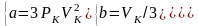 .
.
Полученные
соотношения показывают, что для каждого
реального газа необходимо вычислять
его индивидуальную газовую постоянную
,
которая отличается от молярной газовой
постоянной
 причем оказывается индивидуальная
газовая постоянная меньше, чем молярная.
Поскольку газовая постоянная
пропорциональна числу молекул в моле,
заключаем, что в критическом состоянии
происходит уменьшение структурных
единиц, образующих газовую постоянную,
т.е. молекулы объединяются в комплексы.
При удалении от критического состояния
эти комплексы распадаются, и индивидуальная
газовая постоянная становится равной
молярной.
причем оказывается индивидуальная
газовая постоянная меньше, чем молярная.
Поскольку газовая постоянная
пропорциональна числу молекул в моле,
заключаем, что в критическом состоянии
происходит уменьшение структурных
единиц, образующих газовую постоянную,
т.е. молекулы объединяются в комплексы.
При удалении от критического состояния
эти комплексы распадаются, и индивидуальная
газовая постоянная становится равной
молярной.
Е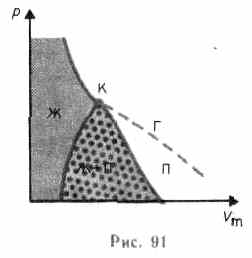 сли
через крайние точки горизонтальных
участков семейства изотерм провести
линию, то получится колоколообразная
кривая (рис. 91), ограничивающая область
двухфазных состояний вещества. Эта
кривая и критическая изотерма делят
диаграмму
,
под
изотермой на три области: под
колоколообразной кривой располагается
область двухфазных состояний (жидкость
и насыщенный пар), слева от нее
находится область жидкого состояния,
а справа — область пара. Пар отличается
от остальных газообразных состояний
тем, что при изотермическом сжатии
претерпевает процесс сжижения. Газ же
при температуре выше критической не
может быть превращен в жидкость ни при
каком давлении.
сли
через крайние точки горизонтальных
участков семейства изотерм провести
линию, то получится колоколообразная
кривая (рис. 91), ограничивающая область
двухфазных состояний вещества. Эта
кривая и критическая изотерма делят
диаграмму
,
под
изотермой на три области: под
колоколообразной кривой располагается
область двухфазных состояний (жидкость
и насыщенный пар), слева от нее
находится область жидкого состояния,
а справа — область пара. Пар отличается
от остальных газообразных состояний
тем, что при изотермическом сжатии
претерпевает процесс сжижения. Газ же
при температуре выше критической не
может быть превращен в жидкость ни при
каком давлении.
Сравнивая
изотерму Ван-дер-Ваальса с изотермой
Эндрюса (верхняя кривая на рис. 92), видим,
что последняя имеет прямолинейный
у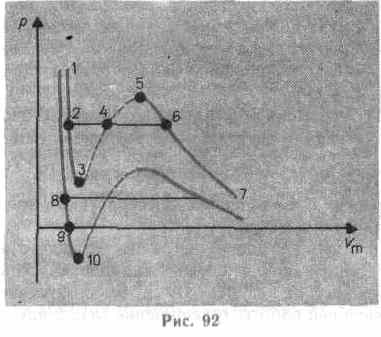 часток
2—6,
соответствующий
двухфазным состояниям вещества. Правда,
при некоторых условиях могут быть
реализованы состояния, изображаемые
участками ван-дер-ваальсовой изотермы
5—6
и
2—3.
Эти
неустойчивые состояния называются
метастабильными.
часток
2—6,
соответствующий
двухфазным состояниям вещества. Правда,
при некоторых условиях могут быть
реализованы состояния, изображаемые
участками ван-дер-ваальсовой изотермы
5—6
и
2—3.
Эти
неустойчивые состояния называются
метастабильными.
Участок 2—3 изображает перегретую жидкость,
5—6 — пересыщенный пар. Обе фазы ограниченно устойчивы.
При достаточно низких температурах изотерма пересекает ось , переходя в область отрицательных давлений (нижняя кривая на рис. 92). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости, участок 9— 10 — растянутой жидкости.
