
- •Экзаменационный билет № 1
- •1. Собственная масса m0. Соответствующую массу будем определять как константу, входящую в релятивистское соотношение
- •5.Время жизни частицы - средняя продолжительность существования нестабильных элементарных частиц. Согласно теории относительности
- •Проблема построения единой теории сильного, слабого и электромагнитного взаимодействий (модели Великого объединения)
- •Экзаменационный билет № 2
- •Существуют 4 типа взаимодействия:
- •Экзаменационный билет № 3
- •38. Ядерные взаимодействия и ядерные реакции. Общие закономерности и различные механизмы ядерных реакций. Особенности протекания ядерных реакций под действием различных частиц.
- •Экзаменационный билет № 4
- •37.Радиоактивность и закономерности радиоактивного распада; процессы сопровождающие радиоактивный распад и их физическая интерпретация.
- •Экзаменационный билет № 5
- •Экзаменационный билет № 6
- •6. Механика жидкости и газа. Основные уравнения равновесия и движения жидкостей. Гидростатика несжимаемой жидкости. Барометрическая формула.
- •35.Элементы зонной теории твердых тел. Обобществление электронов в кристалле, энергетический спектр электронов в кристалле, металлы, диэлектрики и полупроводники с точки зрения зонной модели.
- •Экзаменационный билет № 7
- •Экзаменационный билет № 8
- •2 Волновая функция и ее свойства. Уравнения Шредингера для стационарных состояний. Принцип причинности в квантовой механике
- •Экзаменационный билет № 9
- •Экзаменационный билет № 10
- •Экзаменационный билет № 11
- •Экзаменационный билет № 12
- •Экзаменационный билет № 13
- •Экзаменационный билет № 14
- •Общие условия равновесия и устойчивости
- •Равновесие гомогенной системы
- •Экзаменационный билет № 15
- •Экзаменационный билет № 16
Экзаменационный билет № 13
1. Строение кристаллов. Внутрикристаллические силы. Физические типы кристаллических решеток. Пространственная решетка. Миллеровские индексы. Классификация кристаллов. Классификация дефектов в кристаллах. Реальные кристаллы. Блочная структура. Дислокации. Контур и вектор Бюргерса. Механические свойства твердых тел. Физические процессы при деформации. Пластическая деформация. Движение дислокаций. Генерирование дислокаций. Источник Франка-Рида.
2. Фазовые переходы. Фазовые переходы 1-го рода. Уравнение Клапейрона-Клаузиуса. Фазовые переходы 2-го рода. Уравнение Эренфеста. Критические и закритические явления.
1. Строение кристаллов. Внутрикристаллические силы. Физические типы кристаллических решеток. Пространственная решетка. Миллеровские индексы. Классификация кристаллов. Классификация дефектов кристаллов. Реальные кристаллы. Блочная структура. Дислокации. Контур и вектор Бюргерса. Механические свойства твердых тел. Физические процессы при деформации. Пластичная деформация. Движение дислокаций. Генерирование дислокаций. Источник Франка – Рида.
Подавляющее большинство твердых тел в природе имеет кристаллическое строение. Характерная черта кристаллического состояния - анизотропия, т. е. зависимости ряда физических свойств (механических, тепловых, электрических, оптических) от направления. Причиной анизотропии кристаллов служит упорядоченное расположение частиц (атомов или молекулРаскалывание кристаллов легче происходит по определенным плоскостям, называемым плоскостями спайности.
Весь кристалл может быть получен путем многократного повторения в трех различных направлениях одного и того же структурного элемента, называемого элементарной кристаллической ячейкой. Длины ребер а, b и с кристаллической ячейки называются периодами идентичности кристалла. Кристаллическая ячейка представляет собой параллелепипед, построенный на трех векторах а, b, с, модули которых равны периодам идентичности. Этот параллелепипед, кроме ребер а, b, с, характеризуется также углами , и между ребрами. Величины а, b, с и , и однозначно определяют элементарную ячейку и называются ее параметрами.
Внутреннее строение кристаллов. Давно предполагали, что внешняя форма кристалла отражает его внутреннее строение и обусловлена правильным расположением частиц, составляющих кристалл, — молекул, атомов или ионов. Это расположение можно представить в виде кристаллической решетки — пространственного каркаса, образованного пересекающимися прямыми линиями. В точках пересечения линий— узлах решетки — лежат центры частиц. Физические типы кристаллических решеток. В зависимости от природы частиц, помещающихся в узлах кристаллической решетки, и от характера сил взаимодействия между частицами различают четыре типа кристаллических решеток и соответственно четыре типа кристаллов: ионные, атомные, металлические и молекулярные.
Ионные кристаллы. В узлах кристаллической решетки помещаются ионы разных знаков. Силы взаимодействия между ними являются в основном электростатическими (кулоновскими). Связь, обусловленная электростатическими силами притяжения между разноименно заряженными ионами, называется гетеро-полярной (или ионной). Типичным примером ионной решетки может служить решетка соли NaCl. Эта решетка принадлежит к кубической системе. Ближайшими соседями иона данного знака будут ионы противоположного знака. Ионный кристалл состоит не ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
Атомные кристаллы. В узлах кристаллической решетки помещаются нейтральные атомы. Связь, объединяющая в кристалле (а также и в молекуле) нейтральные атомы, называется гомеополярной (или ковалентной). Силы взаимодействия при гомеополярной связи имеют также электрический (но не кулоновский) характер. Объяснение этих сил может быть дано только на основе квантовой механики. Гомеополярная связь осуществляется электронными парами. Это означает, что в обеспечении связи между двумя атомами участвует по одному электрону от каждого атома. По этой причине гомеополярная связь имеет направленный характер. При гетерополярной связи каждый ион воздействует на все достаточно близкие к нему ионы. При гомеополярной связи воздействие направлено на тот атом, с которым у данного атома имеется совместная электронная пара. Гомеополярная связь может осуществляться только валентными, т, е, наименее связанными с атомом электронами. Поскольку каждый электрон может обеспечить связь только с одним атомом, число связей, в которых может участвовать данный атом (число соседей, с которыми он может быть связан), равно его валентности. Типичными примерами атомных кристаллов могут служить алмаз и графит. Оба эти вещества тождественны по химической природе (они построены из атомов углерода), но отличаются кристаллическим строением. Такую же решетку, как у алмаза (решетку типа алмаза), имеют типичные полупроводники — германий (Ge) и кремний (Si). Для этой решетки характерно то, что каждый атом окружен четырьмя равноотстоящими от него соседями, расположенными в вершинах правильного тетраэдра. Каждый из 4 валентных электронов входит в электронную пару, связыв. данный атом с одним из соседей.
Металлические кристаллы. Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы; в противном случае решетка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решетки и не могут ее покинуть. Большинство металлов имеет решетки одного из трех типов: кубическую объемно-центрированную , кубическую гранецентрированную и так называемую плотную гексагональную Кубическая гранецентрированная и плотная гексагональная решетки соответствуют наиболее плотной упаковке одинаковых шаров.
Молекулярные кристаллы. В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности. По этой причине их называют ван-дер-ваальсовскими силами. Молекулярные решетки образуют следующие вещества: Н2, Na, О2, СО2, Н2О. Пространственная решетка. Пространственные решетки, например, относящиеся к кубической сингонии, бывают простые и сложные: объемно - и гране- центрированные. В простой решетке на одну ячейку приходится одна частица, так как в каждой ячейке имеется 8 вершин, а каждая частица в вершине относится в свою очередь к 8 ячейкам: (
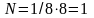 ).
В объемно-центрированной решетке на
одну ячейку приходится две частицы: (
N=1/8·8+1=2),
в гранецентрированной – 4: (N=1/8·8+1/2·6=4).
).
В объемно-центрированной решетке на
одну ячейку приходится две частицы: (
N=1/8·8+1=2),
в гранецентрированной – 4: (N=1/8·8+1/2·6=4).
Миллеровские
индексы.
Если
параметры граней измерять осевыми
единицами (в единицах а, b
и с, т. е. х = A·a,
y
=В·b, z = С·с), то при таком методе
характеристики положения граней
выявляется весьма важный закон - закон
рациональных отношений. Параметры любой
грани кристалла А, В, С, выраженные в
осевых единицах, относятся как простые
целые числа - индексы грани h, k, l
(индексы Миллера).
Индексы
грани - это величины, обратно
пропорциональные параметрам грани
А, В, С: (1/А: 1/В: 1/С = h: k: l.). Совокупность
индексов грани называется символом
грани: (hkl); символ единичной грани (111).
Если грань пересекает отрицательные
направления осей, символ запишется (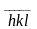 ).
Найдем, например, индексы грани с
параметрами: А=2, В = 5,С = 2 . Отношение
индексов граней (1/2: 1/5: 1/2 = h: k: l). Приведем
дроби к общему знаменателю 10, который
после этого отбросим. Получим: h:k:l =
5:2:5. Следовательно, символ грани (525).
Если грань параллельна одной из осей,
например X, (0kl); если грань параллельна
двум осям, например, Y и Z, ее символом
будет (h00). Разделив на h, получаем
окончательно (100). Помимо обозначений
отдельных граней (hkl) применяйся
обозначения для совокупности сходных
граней {hkl}. Например, обозначение {100}
заменяет совокупность (100), (010), (001),
(
).
Найдем, например, индексы грани с
параметрами: А=2, В = 5,С = 2 . Отношение
индексов граней (1/2: 1/5: 1/2 = h: k: l). Приведем
дроби к общему знаменателю 10, который
после этого отбросим. Получим: h:k:l =
5:2:5. Следовательно, символ грани (525).
Если грань параллельна одной из осей,
например X, (0kl); если грань параллельна
двум осям, например, Y и Z, ее символом
будет (h00). Разделив на h, получаем
окончательно (100). Помимо обозначений
отдельных граней (hkl) применяйся
обозначения для совокупности сходных
граней {hkl}. Например, обозначение {100}
заменяет совокупность (100), (010), (001),
( ),(
),( )(
)(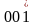 ).
Направление, перпендикулярное грани
(hkl), обозначается {hkl}. Совокупность
направлений, перпендикулярных граням,
обозначается <hkl>.
).
Направление, перпендикулярное грани
(hkl), обозначается {hkl}. Совокупность
направлений, перпендикулярных граням,
обозначается <hkl>.
Классификация кристаллов. Кристаллическая решетка может обладать различными видами симметрии. Под симметрией кристаллической решетки понимается свойство решетки совпадать с самой собой при некоторых пространственных перемещениях. Всякая решетка прежде всего обладает трансляционной симметрией, т. е. совпадает сама с собой при перемещении (трансляции) на величину периода идентичности. Из других видов симметрии - симметрия по отношению к поворотам вокруг некоторых осей, а также к зеркальному отражению относительно определенных плоскостей.
Если решетка совпадает сама с собой при повороте вокруг некоторой оси на угол 2/n (следовательно, за один полный поворот вокруг оси решетка совпадает сама с собой n раз), то эта ось называется осью симметрии n-го порядка. Можно показать, что, кроме тривиальной оси 1-го порядка, возможны только оси симметрии 2-го, 3-го, 4-го и 6-го порядков. Плоскости, при зеркальном отражении от которых решетка совпадает сама с собой, называются плоскостями симметрии. Различные виды симметрии называются элементами симметрии кристаллической решетки. Кристаллическая решетка обладает одновременно несколькими видами симметрии. Однако не всякое сочетание элементов симметрии оказывается возможным. По форме элементарной ячейки все кристаллы делятся на 7 кристаллографических систем (или сингонии), каждая из которых включает в себя несколько классов симметрии. В порядке возрастающей симметрии кристаллогр. системы располагаются следующим образом.
Триклинная система. a b c; . Элем.ячейка имеет форму косоуг. параллелепипеда.
Моноклинная система. a b c; = = 90°; 900. Элементарная ячейка имеет форму прямой призмы, в основании которой лежит параллелограмм .
Ромбическая система. все ребра — разные: a b c; ===90°. Элем. ячейка имеет форму прямоугольного параллелепипеда.
Тетрагональная система. Все углы — прямые, два ребра — одинаковые: а = b c; ===90°. Элементарная ячейка имеет форму прямой призмы с квадратным основанием.
Ромбоэдрическая (или тригональная) система. Все ребра — одинаковые, все углы также одинаковые и отличные от прямого: а = b = c; = = 90°. Элементарная ячейка имеет форму куба, деформированного сжатием или растяжением вдоль диагонали.
Гексагональная система. а = b c; а = b = 90°, = 120°. Если составить вместе три элементарные ячейки, то получается правильная шестигранная призма.
Кубическая система. а = b = с; ===90°. Элементарная ячейка имеет форму куба.
Классификация дефектов кристаллов. Дефектами кристаллов называют нарушения идеальной кристаллической структуры (может заключаться в отсутствии атома в узле решетки (вакансия), в замене атома данного вещества (своего атома), чужим атомом (атомом примеси), во внедрении лишнего атома (своего или чужого) в межузельное пространство). Подобные дефекты называются точечными, вызывают нарушения правильности решетки, распространяющиеся на расстояния порядка нескольких периодов. Дислокации. Контур и вектор Бюргерса. существуют дефекты, сосредоточенные вблизи некоторых линий. Их называют линейными дефектами или дислокациями. Дефекты такого вида нарушают правильное чередование кристаллических плоскостей. Простейшими видами дислокаций являются краевая и винтовая дислокации. Краевая дислокация обусловливается лишней кристаллической полуплоскостью, вдвинутой между двумя соседними слоями атомов. Край этой полуплоскости образует дислокацию данного вида. Винтовую дислокацию можно представить как результат разреза кристалла по полуплоскости и последующего сдвига лежащих по разные стороны разреза частей решетки навстречу друг другу на величину одного периода. Внутренний край разреза образует винтовую дислокацию. Кристалл с винтовой дислокацией состоит из одной кристаллической плоскости, которая изогнута по винтовой поверхности (такую поверхность называют геликоидом). Линия дислокации совпадает с осью винта. При каждом обходе вокруг этой линии кристаллическая плоскость смещается на один период. В обоих случаях линии дислокации являются прямыми. В общем случае линии дислокации могут быть кривыми. Винтовая дислокация часто возникает в процессе роста кристаллов из раствора или расплава. Захват атома гладкой плоской кристаллической поверхностью энергетически менее выгоден и поэтому менее вероятен, чем присоединение атома к ступеньке, существующей на поверхности кристалла с винтовой дислокацией. Поэтому кристаллы предпочитают расти со встроенной внутрь винтовой дислокацией. Новые атомы присоединяются к краю ступеньки, вследствие чего рост кристалла происходит по спирали. Контур Бюргерса строится вдоль обхода линейного несовершенства.Пластичная деформация. Дефекты оказывают сильное влияние на физические свойства кристаллов, служат причиной того, что пластическая деформация реальных кристаллов происходит под воздействием напряжений на несколько порядков меньших, чем вычисленное для идеальных кристаллов. Движение дислокаций. У монокристаллов металлов легко происходит сдвиг вдоль атомных слоев. Не следует представлять себе этот процесс так, что все атомы слоя смещаются одновременно как одно целое. В действительности атомы перескакивают в новые положения небольшими группами поочередно. Такое поочередное перемещение атомов может быть представлено как движение дислокации. Для перемещения дислокации достаточно напряжений, много меньших, чем для перемещения всего атомного слоя сразу. Первоначально имевшаяся дислокация под воздействием созданных в кристалле напряжений перемещается вдоль кристалла. Это перемещение сопровождается поочередным сдвигом атомов слоя, лежащего над дислокацией, относительно атомов слоя, лежащего под дислокацией. Перемещению дислокаций препятствует наличие других дефектов в кристалле, например, присутствие атомов примеси. Дислокации тормозятся также при пересечении друг с другом. Если количество дислокаций и других дефектов в кристалле мало, дислокации перемещаются практически свободно. В результате сопротивление сдвигу будет невелико. Увеличение плотности дислокаций и возрастание концентрации примесей приводит к сильному торможению дислокаций и прекращению их движения. В результате прочность материала растет. Так, например, повышение прочности железа достигается растворением в нем атомов углерода (такой раствор представляет собой сталь).
Реальные кристаллы. В реальных кристаллах наблюдаются дефекты структур. Число этих дефектов и их тип оказывают влияние на некоторые свойства кристаллических веществ.
Генерирование дислокаций. Источник Франка – Рида. Плотность дислокаций уменьшается, следовательно прочность увеличивается. Но в действительности этого нет, так как в нутрии имеются генераторы дислокаций. Наступает момент. Когда дислокации соприкасаются и образуется дислокационная петля, которая движется и создает новые дислокации. Источник Франка – Рида – бесконечный неиссякаемый дислокационный источник дислокационных линий. Прочность уменьшается, кристаллы разрушаются.
2. Фазовые переходы. Фазовые переходы 1-го рода. Уравнение Клапейрона-Клаузиуса. Фазовые переходы 2-го рода. Уравнение Эренфеста. Критические и закритические явления.
При равновесии, а следовательно, и при фазовых превращениях химические потенциалы вещества в фазах, а также давление (при плоской поверхности) и температура фаз всегда одинаковы. Что же касается других термических и калорических величин (или соответствующих им производных разных порядков от энергии Гиббса), то они при фазовых превращениях теряют непрерывность. Фазовые превращения, при которых скачком изменяется удельный объем v и поглощается (или выделяется) теплота называются фазовыми переходами первого рода. Объем и энтропия выражаются через первые производные энергии Гиббса:
![]()
Исходя из этого,
Эренфест предложил классификацию
фазовых переходов, по которой
порядок фазового перехода определяется
порядком тех производных термодинамического
потенциала, которые при переходе
испытывают скачки: при фазовых переходах
первого рода испытывают скачки (все
или только некоторые) первые производные
энергии Гиббса, при фазовых переходах
второго рода первые производные энергии
Гиббса непрерывны,
но испытывают скачки его вторые
ппоизводные—теплоемкость(СР=![]() ),
сжимаемость (
),
сжимаемость (![]() ),
коэффициент теплового расширения (
),
коэффициент теплового расширения (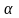
![]() ).
).
В настоящее время известны фазовые переходы первого рода: плавление, кипение, переход проводника из нормального состояния в сверхпроводящее в магнитном поле, переходы из одной кристаллической модификации в другую и т. д., фазовый переход второго рода — превращение проводника из нормального состояния в сверхпроводящее при отсутствии магнитного поля, а также большое число фазовых переходов, при которых вторые производные термодинамического потенциала обращаются в бесконечность (критические переходы): критический переход жидкость —газ, переход ферромагнетика в парамагнетик, сегнетоэлектрический переход и др. Критические переходы не укладываются в классификацию фазовых переходов Эренфеста, указывая на ее ограниченность.
Основным
уравнением, характеризующим фазовые
переходы первого
рода, является дифференциальное уравнение
Клапейрона — Клаузиуса. Это уравнение
получается из условия равенства
химических потенциалов при равновесии
двух фаз
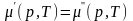 и связывает между собой теплоту перехода,
скачок удельного объема и наклон кривой
равновесия в точке перехода.
и связывает между собой теплоту перехода,
скачок удельного объема и наклон кривой
равновесия в точке перехода.
Из
формулы следует уравнение кривой
равновесия р=р(Т). Однако дифференциальное
уравнение кривой равновесия имеет
нораздо более простой вид и связывает
медлу собой указанные выше лекщгко
измеряемые величины:
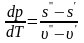 .
(12.3)
.
(12.3)
Уравнение
является дифференциальным уравнением
кривой равновесия и называется уравнением
Клапейрона — Клаузиуса. Чаще
его записывают в виде:
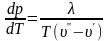 (12.4)
(12.4)
где
 — теплота
перехода на моль или грамм вещества;
v"
—
v'
—
изменение
объема соответствующей массы вещества.
Главное применение уравнения состоит
в вычислении удельных
теплот испарения, возгонки, плавления
и изменения модификации.
— теплота
перехода на моль или грамм вещества;
v"
—
v'
—
изменение
объема соответствующей массы вещества.
Главное применение уравнения состоит
в вычислении удельных
теплот испарения, возгонки, плавления
и изменения модификации.
Если на систему
действует не давление р,
а какая-либо
другая обобщенная
сила А,
то
мы получаем общее
дифференциальное уравнение
кривой равновесия двух фаз однокомпонентной
системы:
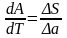 .(s
– изменение энтропии , а – скачок
внешнего параметра).
.(s
– изменение энтропии , а – скачок
внешнего параметра).
Уравнением
Клапейрона — Клаузиуса: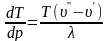 определяет изменение температуры
фазового перехода (например, точки
замерзания или кипения) с изменением
давления.
определяет изменение температуры
фазового перехода (например, точки
замерзания или кипения) с изменением
давления.
ФАЗОВЫЕ ПЕРЕХОДЫ ВТОРОГО РОДА. УРАВНЕНИЕ ЭРЕНФЕСТА
В отличие от фазовых переходов первого рода при фазовых переходах второго рода никакого скачка в изменении состояния не происходит. Состояние системы изменяется непрерывно, и в точках фазового перехода состояния фаз совпадают. Тепловой эффект перехода равен нулю, и удельный объем остается прежним (s’’=s’, v’’=v’), но теплоемкость Ср, коэффициент теплового расширения и сжимаемость испытывают скачки. Связь между этими скачками и наклоном кривой равновесия в точке перехода определяется уравнениями Эренфеста, который впервые (1933) ввел представление о фазовых переходах второго рода при рассмотрении перехода Неl в Неll.
До недавнего времени к фазовым переходам второго рода помимо сверхпроводящего перехода при отсутствии магнитного поля относили также превращение железа в точке Кюри в парамагнитное состояние, переход Неl в Неll, многие превращения в кристаллах. По современным представлениям, только сверхпроводящий переход при Н = 0 является переходом второго рода по Эренфесту, остальные же из названных переходов имеют другую природу.
Найдем уравнения Эренфеста. Правая часть уравнения Клапейрона — Клаузиуса (12.3) в точке фазового перехода второго рода принимает вид неопределенности О/О. Для ее раскрытия воспользуемся правилом Лопиталя. Дифференцируя числитель и знаменатель правой части (12.3) или по Т, или по р, получаем уравнения Эренфеста:
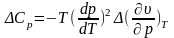
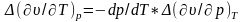
В общем случае, если на систему действует обобщенная сила А, которой соответствует внешний параметр а, уравнения Эренфеста будут иметь вид (то же, с заменой р на А, v на а).
Уравнения Эренфеста связывают скачки вторых производных термодинамического потенциала не только при фазовых переходах второго рода, но и в случае целого ряда фазовых переходов первого рода. Примером такого перехода первого рода является переход из упорядоченного состояния в неупорядоченное в сплавах AuCu3, AuCu и др. Характерной особенностью этих фазовых переходов является постоянство скачков объема и энтропии на всей линии превращения:
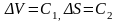 ,
(12.12)
,
(12.12)
так что на диаграмме
Т, р наклон
линии фазового равновесия dp/dT= S/
V
оказывается
постоянным и, следовательно, сама эта
линия есть прямая (линейные фазовые
переходы первого рода). Дифференцируя
уравнение (12.12)
по
температуре вдоль линии равновесия,
получаем выражения откуда
непосредственно следуют уравнения
Эренфеста.
S/
V
оказывается
постоянным и, следовательно, сама эта
линия есть прямая (линейные фазовые
переходы первого рода). Дифференцируя
уравнение (12.12)
по
температуре вдоль линии равновесия,
получаем выражения откуда
непосредственно следуют уравнения
Эренфеста.
Таким образом, уравнения Эренфеста определяют широкий класс фазовых превращений — линейные фазовые переходы первого рода и фазовые переходы второго рода.
КРИТИЧЕСКИЕ И ЗАКРИТИЧЕСКИЕ ЯВЛЕНИЯ
В 1860 г. Д. И. Менделеев, исследуя зависимость поверхностного натяжения жидкостей от температуры, установил, что при некоторой температуре, названной им температурой абсолютного кипения, поверхностное натяжение исчезает. При этом обе сосуществующие фазы (жидкость и пар) становятся тождественными. Такое состояние характеризуется определенными значениями температуры Ткр, давления ркр и объема Vкр и называется критическим состоянием. Кривая равновесия жидкости и пара на диаграмме Т, р кончается в критической точке.
На основании этих экспериментальных исследований Дж. В. Гиббс (1876) и независимо от него А. Г. Столетов (1879) сформулировали основные положения классической термодинамической теории критических явлений. По Гиббсу — Столетову, критическая фаза представляет собой предельный случай двухфазного равновесия, когда обе равновесно сосуществующие фазы становятся тождественными. Иначе говоря, это устойчивое состояние однородной системы, лежащее на границе устойчивости по отношению к виртуальным изменениям каждой ее координаты при постоянстве других термодинамических сил.
Математически граница устойчивости однородной системы по отношению к таким виртуальным изменениям ее координат определяется обращением в равенства термодинамических неравенств, характеризующих эту устойчивость однородной системы: (dp/dV)T=0, (dT/dV)p=0, (dT/dS)p=0, (dp/dS)T=0.
Условия устойчивости критического состояния: T S- p V>0.
Критическое состояние определяется четырьмя уравнениями для функции двух переменных, не может в данном случае привести к противоречию, так как, согласно термодинамическому тождеству
![]() только
два из приведенных уравнений являются
независимыми.
только
два из приведенных уравнений являются
независимыми.
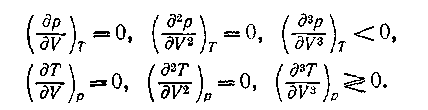
Критическое состояние системы жидкость — пар — это однокомпонентная, однофазная система, поэтому по правилу фаз n<k число степеней свободы критического состояния fкр=k-n=0.
Это означает, что критическое состояние простой однокомпонентной системы возможно лишь при определенных температуре, давлении и объеме, т. е. в одной критической точке Ткр, ркр, Vкр, Параметры критической точки зависят только от свойств данного вещества.
С изменением термодинамических сил, действующих на систему, изменяются различные характеристики фазового перехода первого рода (ФП I рода). Так, при повышении температуры и давления в системе жидкость — пар уменьшаются удельная теплота перехода и области метастабильных и неустойчивых состояний (см. рис. 46). Предельным случаем ФП I рода является критический переход.
Как показывается в статистической физике, коэффициенты устойчивости обратно пропорциональны флуктуациям различных физических величин. С приближением к критической точке флуктуации растут. За критической точкой существуют только устойчивые состояния, поэтому в этой области невозможно сосуществование фаз, имеющих границу раздела. Анализ термодинамической устойчивости закритической фазы привел В. К. Семенченко к построению термодинамики непрерывных фазовых переходов.
Как уже упоминалось, рассмотрение изотерм вблизи критической точки показывает, что точки перегиба на этих изотермах имеются и в закритической области. Но точка перегиба на кривой соответствует экстремумам на кривых для ее первых производных, В точках квазиспинодали флуктуации достигают при данных условиях наибольшего значения и система превращается в смесь флуктуационных зародышей обеих граничных (далеких от этого состояния) фаз — квазифазу или мезофазное состояние*, не теряя своей макроскопической однородности. Поскольку минимум устойчивости является поворотной точкой в отношении изменения свойств фаз, он до некоторой степени аналогичен точке фазового перехода второго рода и условно его можно считать за точку закритического перехода. При этом, конечно, не нужно забывать, что закритический переход происходит на конечном интервале Т, р и других термодинамических сил. Поэтому в условной точке закритического перехода не происходит скачков энтропии, объема и других я,-, а только их быстрое изменение. Работа и удельная теплота перехода также равны по этой причине нулю. Сами коэффициенты устойчивости изменяются также непрерывно, а не скачком; в этом состоит отличие закритических переходов от ФП II рода по Эренфесту.
До сих пор мы для определенности пользовались диаграммами, относящимися к флюидным системам, т. е. системам газ — жидкость. Однако все изложенное применимо и к анизотропным системам, а также к системам, фазы которых отличаются по своим магнитным или электрическим свойствам (ферро-и антиферромагнетики, сверхпроводники и сегнетоэлектрики разных типов).
Очень интересный случай критического перехода в анизотропной среде представляет а-^-переход в кварце. Он сопровождается резко выраженной критической опалесценцией и экстремумами нескольких КУ. Но самым интересным является возможность непосредственного наблюдения смешанного состояния обеих граничных фаз.
