
- •Экзаменационный билет № 1
- •1. Собственная масса m0. Соответствующую массу будем определять как константу, входящую в релятивистское соотношение
- •5.Время жизни частицы - средняя продолжительность существования нестабильных элементарных частиц. Согласно теории относительности
- •Проблема построения единой теории сильного, слабого и электромагнитного взаимодействий (модели Великого объединения)
- •Экзаменационный билет № 2
- •Существуют 4 типа взаимодействия:
- •Экзаменационный билет № 3
- •38. Ядерные взаимодействия и ядерные реакции. Общие закономерности и различные механизмы ядерных реакций. Особенности протекания ядерных реакций под действием различных частиц.
- •Экзаменационный билет № 4
- •37.Радиоактивность и закономерности радиоактивного распада; процессы сопровождающие радиоактивный распад и их физическая интерпретация.
- •Экзаменационный билет № 5
- •Экзаменационный билет № 6
- •6. Механика жидкости и газа. Основные уравнения равновесия и движения жидкостей. Гидростатика несжимаемой жидкости. Барометрическая формула.
- •35.Элементы зонной теории твердых тел. Обобществление электронов в кристалле, энергетический спектр электронов в кристалле, металлы, диэлектрики и полупроводники с точки зрения зонной модели.
- •Экзаменационный билет № 7
- •Экзаменационный билет № 8
- •2 Волновая функция и ее свойства. Уравнения Шредингера для стационарных состояний. Принцип причинности в квантовой механике
- •Экзаменационный билет № 9
- •Экзаменационный билет № 10
- •Экзаменационный билет № 11
- •Экзаменационный билет № 12
- •Экзаменационный билет № 13
- •Экзаменационный билет № 14
- •Общие условия равновесия и устойчивости
- •Равновесие гомогенной системы
- •Экзаменационный билет № 15
- •Экзаменационный билет № 16
Экзаменационный билет № 10
1. Основное уравнение молекулярно-кинетической теории идеальных газов (уравнение Клаузиуса, уравнение Больцмана). Закон Дальтона. Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия идеального газа. Закон Дюлонга и Пти. Закон Неймана-Коппа. Классическая теория теплоемкости. Уравнение Роберта-Майера. Недостатки классической теории теплоемкости.
2. Двойственная корпускулярно-волновая природа частиц вещества. Гипотеза де Бройля. Экспериментальное подтверждение теории де Бройля. Опыты Дэвиссона и Джермера
1.
Основное уравнение молекулярно-кинетической
теории идеальных газов (уравнение
 Клаузиуса,
уравнение Больцмана). Закон Дальтона.
Закон равномерного распределения
энергии по степеням свободы. Внутренняя
энергия идеального газа. Закон Дюлонга
и Пти. Закон Неймана-Коппа. Классическая
теория теплоемкости. Уравнение
Роберта-Майера. Недостатки классической
теории теплоемкости.
Клаузиуса,
уравнение Больцмана). Закон Дальтона.
Закон равномерного распределения
энергии по степеням свободы. Внутренняя
энергия идеального газа. Закон Дюлонга
и Пти. Закон Неймана-Коппа. Классическая
теория теплоемкости. Уравнение
Роберта-Майера. Недостатки классической
теории теплоемкости.
Рассмотрим
одноатомный идеальный газ. молекулы
газа движутся хаотически, число взаимных
столкновений между молекулами газа
пренебрежимо мало по сравнению с
числом ударов о стенки сосуда, а соударения
молекул со стенками сосуда абсолютно
упругие.
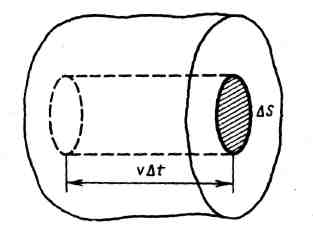
Выделим на стенке сосуда некоторую
элементарную площадку ΔS
и
вычислим давление, оказываемое на эту
площадку. При каждом соударении молекула,
движущаяся перпендикулярно площадке,
передает ей импульс m0
v—(—m0
v)
= 2m0
v,
где
m0
— масса молекулы, v
—
ее скорость. За время Δt
площадки ΔS
достигнут только
те
молекулы, которые заключены в объеме
цилиндра с основанием ΔS
и
высотой vΔt
(рис.).
Число этих молекул равно nΔSvΔt
(n—
концентрация молекул).Необходимо
учитывать, что реально молекулы движутся
к площадке ΔS
под
разными углами и имеют различные
скорости, причем скорость молекул при
каждом
соударении меняется. Для упрощения
расчетов хаотическое движение молекул
заменяют
движением вдоль трех взаимно
перпендикулярных направлений, так что
в
любой момент времени вдоль каждого из
них движется 1/3 молекул, причем 1/6
движется вдоль данного направления в
одну сторону, 1/6
— в противоположную.
Тогда число ударов молекул, движущихся
в заданном направлении, о
площадку ΔS
будет 1/6
nΔSvΔt.
При столкновении с площадкой эти молекул
передадут
ей импульс.
![]() Тогда
давление газа, оказываемое им на стенку
сосуда,
Тогда
давление газа, оказываемое им на стенку
сосуда,![]() (1).Если
газ в объеме V
содержит
N
молекул,
движущихся со скоростями v1,v2,
...,
vN,
то
целесообразно
рассматривать среднюю
квадратичную скорость
(1).Если
газ в объеме V
содержит
N
молекул,
движущихся со скоростями v1,v2,
...,
vN,
то
целесообразно
рассматривать среднюю
квадратичную скорость
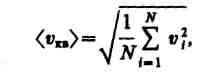 (2), характеризующую
всю совокупность молекул газа. Уравнение
(1) с учетом (2) примет вид
(2), характеризующую
всю совокупность молекул газа. Уравнение
(1) с учетом (2) примет вид![]() Выражение
(3) называется основным
уравнением молекулярно-кннетнческой
теории
идеальных газов. Точный
расчет с учетом движения молекул по
всевозможным направлениям
дает ту же формулу.Учитывая,
что n=N/V,
получим
Выражение
(3) называется основным
уравнением молекулярно-кннетнческой
теории
идеальных газов. Точный
расчет с учетом движения молекул по
всевозможным направлениям
дает ту же формулу.Учитывая,
что n=N/V,
получим
![]()
![]() (5)
(5)
где Е — суммарная кинетическая энергия поступательного движения всех молекул газа.
Так
как масса газа m=Nm0,
то уравнение (4) можно переписать в виде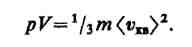
Для
одного моля газа т=М(М
—
молярная масса), поэтому![]()
![]() г
г![]() де
Vm
—
молярный объем. С другой стороны, по
уравнению Клапейрона — Менделеева,
pVm=RT.
Т.о.
де
Vm
—
молярный объем. С другой стороны, по
уравнению Клапейрона — Менделеева,
pVm=RT.
Т.о.
Так
как М=m0NA,
где то
—
масса одной молекулы, a
NA
— постоянная Авогадро, то из
уравнения (6) следует, что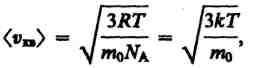 (7), где
k=R/Na
—
постоянная Больцмана. Средняя
кинетическая энергия поступательного
движения одной молекулы идеального
газа
(7), где
k=R/Na
—
постоянная Больцмана. Средняя
кинетическая энергия поступательного
движения одной молекулы идеального
газа
![]() (8) пропорциональна
термодинамической температуре
и зависит только от нее. при T=0
<ε0>=0,
т.
е. при 0 К прекращается поступательное
движение молекул газа, его
давление равно нулю. термодинамическая
температура является мерой
средней кинетической энергии
поступательного движения молекул
идеального газа.Уравнение
Клаузиуса.
(8) пропорциональна
термодинамической температуре
и зависит только от нее. при T=0
<ε0>=0,
т.
е. при 0 К прекращается поступательное
движение молекул газа, его
давление равно нулю. термодинамическая
температура является мерой
средней кинетической энергии
поступательного движения молекул
идеального газа.Уравнение
Клаузиуса.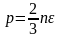 Уравнение
Больцмана.
Уравнение
Больцмана.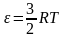 Уравнение
Больцмана в уравнении Клаузиуса.
Уравнение
Больцмана в уравнении Клаузиуса.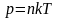
З![]() акон
Дальтона:
давление смеси идеальных газов равно
сумме парциальных давлений p1,
p2…pn
входящих в нее газов:p=p1+p2+….+pn,
Парциальное
давление – давление, которое производил
бы газ, входящий в состав газовой смеси,
если бы он один занимал объем, равный
объему смеси при той же температуре.
Закон
равнораспределения энергии по степеням
свободы.Число
степеней свободы —
наименьшее число линейно независимых
координат, которые полностью определяют
положение тела в пространстве. Число
Iстепеней
свободы материальной точки в пространстве
i
= 3. Закон
равного распределения энергии по
степеням свободы.
На одну
степень свободы любого вида движения
приходится количество энергии, равное
kt/2
акон
Дальтона:
давление смеси идеальных газов равно
сумме парциальных давлений p1,
p2…pn
входящих в нее газов:p=p1+p2+….+pn,
Парциальное
давление – давление, которое производил
бы газ, входящий в состав газовой смеси,
если бы он один занимал объем, равный
объему смеси при той же температуре.
Закон
равнораспределения энергии по степеням
свободы.Число
степеней свободы —
наименьшее число линейно независимых
координат, которые полностью определяют
положение тела в пространстве. Число
Iстепеней
свободы материальной точки в пространстве
i
= 3. Закон
равного распределения энергии по
степеням свободы.
На одну
степень свободы любого вида движения
приходится количество энергии, равное
kt/2![]() где
ε0
—
средняя энергия на одну ст. свободы.
где
ε0
—
средняя энергия на одну ст. свободы.
Если молекула обладает i степенями свободы, то средняя энергия молекулы ε
где i
— число
степеней свободы, к
— постоянная
Больцмана, Т
— абсолютная
температура. Внутренняя
энергия газа, масса которого m,
равна:
![]() где
N —число
молекул, m
— масса
газа, М —
молярная масса, R
—
универсальная газовая постоянная.
где
N —число
молекул, m
— масса
газа, М —
молярная масса, R
—
универсальная газовая постоянная.
Внутренняя энергия идеального газа Вн. Эн. включает в себя энергию всех видов внутреннего движения и энергию взаимодействия всех частиц. Вн. эн.многоатомного газа состоит из:
Кинетической энергии теплового поступательного и вращательного движения молекул.
Кинетической и потенциальной энергии колебаний атомов в молекуле.
Потенциальной энергии, обусловленной межмолекулярными взаимодействиями.
Энергии электронных оболочек атомов и ионов.
Кинетической и потенциальной энергии взаимодействия нуклонов в ядрах атомов.
Т![]() еплоемкость
твердых тел. Закон Дюлонга и Пти.В
качестве модели твердого тела рассмотрим
правильно построенную кристаллическую
решетку, в узлах которой частицы (атомы,
ионы, молекулы), принимаемые за материальные
точки, колеблются около своих положений
равновесия — узлов решетки
— в трех взаимно перпендикулярных
направлениях. Таким образом, каждой
составляющей
кристаллическую решетку частице
приписывается три колебательных степени
свободы,
каждая из которых, согласно закону
равнораспределения энергии по степеням
свободы,
обладает энергией кТ.
Внутренняя
энергия моля твердого тела
еплоемкость
твердых тел. Закон Дюлонга и Пти.В
качестве модели твердого тела рассмотрим
правильно построенную кристаллическую
решетку, в узлах которой частицы (атомы,
ионы, молекулы), принимаемые за материальные
точки, колеблются около своих положений
равновесия — узлов решетки
— в трех взаимно перпендикулярных
направлениях. Таким образом, каждой
составляющей
кристаллическую решетку частице
приписывается три колебательных степени
свободы,
каждая из которых, согласно закону
равнораспределения энергии по степеням
свободы,
обладает энергией кТ.
Внутренняя
энергия моля твердого тела
г![]() де
NА
—
постоянная Авогадро; NА
k=R
(R
—
молярная газовая постоянная). Молярная
теплоемкость твердого тела
де
NА
—
постоянная Авогадро; NА
k=R
(R
—
молярная газовая постоянная). Молярная
теплоемкость твердого тела
т.е. молярная (атомная) теплоемкость химически простых тел в кристаллическом состоянии одинакова (равна 3R) и не зависит от температуры. закон носит название закона Дюлонга и Пти.
Если
твердое тело является химическим
соединением, то число частиц в моле не
равно постоянной Авогадро, а равно nNA,
где
п
—
число атомов в молекуле (для NaCl
число частиц в моле равно 2NA,
так,
в одном моле NaCl
содержится NA
атомов
Na
и NA
атомов С1). Таким образом, молярная
теплоемкость твердых
химических соединений
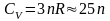 Дж/(мольК),т.
е. равна сумме атомных теплоемкостей
элементов, составляющих это соединение.
Дж/(мольК),т.
е. равна сумме атомных теплоемкостей
элементов, составляющих это соединение.
Классическая
теория теплоемкости. Уравнение
Роберта-Майера. Недостатки классической
теории теплоемкости.Удельная
теплоемкость вещества — величина,
равная количеству теплоты, необходимому
для нагревания 1 кг вещества на 1 К: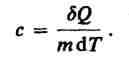 Единица
удельной теплоемкости — джоуль на
килограмм-кельвин (Дж/(кг • К)).
Единица
удельной теплоемкости — джоуль на
килограмм-кельвин (Дж/(кг • К)).
Молярная
теплоемкость — величина, равная
количеству теплоты, необходимому для
нагревания 1 моль вещества на 1 К:![]() (1)где
v=m/M
—
количество вещества.
(1)где
v=m/M
—
количество вещества.
Единица
молярной теплоемкости — джоуль на
моль-кельвин (Дж/(моль; К)). Удельная
теплоемкость с
связана
с молярной Сш
соотношением
![]() (2), где
М
—
молярная масса вещества.
(2), где
М
—
молярная масса вещества.
Различают теплоемкости при постоянном объеме и постоянном давлении.Запишем выражение первого начала термодинамики для 1 моль газа с учетом формул и (1):
![]() (3).
Если газ нагревается при постоянном
объеме, то работа внешних сил равна нулю
и сообщаемая газу извне теплота идет
только на увеличение его внутренней
энергии:
(3).
Если газ нагревается при постоянном
объеме, то работа внешних сил равна нулю
и сообщаемая газу извне теплота идет
только на увеличение его внутренней
энергии:
![]() (4),
т. е. молярная теплоемкость газа при
постоянном объеме Сv
равна
изменению внутренней
энергии 1 моль газа при повышении его
температуры на 1 К. Согласно формуле
dUm=-i/2RdT,
тогда
(4),
т. е. молярная теплоемкость газа при
постоянном объеме Сv
равна
изменению внутренней
энергии 1 моль газа при повышении его
температуры на 1 К. Согласно формуле
dUm=-i/2RdT,
тогда
![]()
![]() (5)
Если газ нагревается при постоянном
давлении, то выражение (3) можно записать
в виде
Учитывая, что
(5)
Если газ нагревается при постоянном
давлении, то выражение (3) можно записать
в виде
Учитывая, что
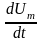 не зависит от вида процесса
(внутренняя энергия идеального газа не
зависит от р и
от К, а определяется T)
и всегда равна
не зависит от вида процесса
(внутренняя энергия идеального газа не
зависит от р и
от К, а определяется T)
и всегда равна
Сv (см. (4)), и дифференцируя уравнение Клапейрона — Менделеева pVm=RT по Т (р=const), получаем
![]() (6). -
уравнение Майера; оно показывает, что
Ср
всегда
больше Сv
на
величину молярной газовой постоянной.
Это объясняется тем, что при нагревании
газа при
постоянном давлении требуется
еще дополнительное количество теплоты
на совершение работы расширения газа,
так как постоянство давления обеспечивается
увеличением объема газа. Использовав
(5), выражение (6) можно записать в виде
(6). -
уравнение Майера; оно показывает, что
Ср
всегда
больше Сv
на
величину молярной газовой постоянной.
Это объясняется тем, что при нагревании
газа при
постоянном давлении требуется
еще дополнительное количество теплоты
на совершение работы расширения газа,
так как постоянство давления обеспечивается
увеличением объема газа. Использовав
(5), выражение (6) можно записать в виде
![]() (7).При
рассмотрении термодинамических процессов
важно знать характерное для каждого
газа отношение Ср
к Сv
:
(7).При
рассмотрении термодинамических процессов
важно знать характерное для каждого
газа отношение Ср
к Сv
:
![]() (8)
(8)
Из формул (5) и (7) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение справедливо в довольно широком интервале температур лишь для одноатомных газов, но молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.По закону равномерного распределения энергии по степеням свободы, для комнатных температур Cv=7/2R. Из качественной экспериментальной зависимости молярной теплоемкости Сv водорода следует, что Сv зависит от температуры: при низкой температуре CV=3/2 R, при комнатной — CV=SI2R (вместо расчетных 7/2 R) и при очень высокой — Сv= 7/2 R. Это можно объяснить, предположив, что при низких температурах наблюдается только поступательное движение молекул, при комнатных — добавляется их вращение, а при высоких — к этим двум видам движения добавляются еще колебания молекул.
при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь определенный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы «замораживается» — к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомного газа — водорода — при комнатной температуре равна 5/2 R вместо 7/2 R. Аналогично можно объяснить уменьшение теплоемкости при низкой температуре («замораживаются» вращательные степени свободы) и увеличение при высокой («возбуждаются» колебательные степени свободы).
2. Двойственная корпускулярно-волновая природа частиц вещества. Гипотеза де Бройля. Экспериментальное подтверждение теории де Бройля. Опыты Дэвиссона и Джермера.
Г

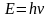 по волновой. В итоге получим
по волновой. В итоге получим
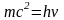 ,
откуда
,
откуда
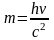 ,
m
– масса фотона.
,
m
– масса фотона.
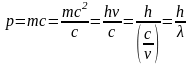 ,
откуда
,
откуда
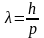 (формула де-Бройля длины волны электрона).
Экспериментальным подтверждением
теории де-Бройля служат опыты Девиссона
и Джермера (1927) – рис. 22.1.1, где 1 –
электронная пушка, 2 – приёмник электронов,
3 – гальванометр (измеряет слабые
электрические токи), 4 – пластинка из
никеля. С классической точки зрения
следовало бы ожидать, что электроны
будут рассеиваться по законам
геометрической оптики. Опыт же показал
чёткую зависимость числа электронов
от их кинетической энергии (рис. 22.1.2).
Первый максимум при энергии электрона
54 эВ, условие максимума отражённых
электронов подчиняется условиям:
(формула де-Бройля длины волны электрона).
Экспериментальным подтверждением
теории де-Бройля служат опыты Девиссона
и Джермера (1927) – рис. 22.1.1, где 1 –
электронная пушка, 2 – приёмник электронов,
3 – гальванометр (измеряет слабые
электрические токи), 4 – пластинка из
никеля. С классической точки зрения
следовало бы ожидать, что электроны
будут рассеиваться по законам
геометрической оптики. Опыт же показал
чёткую зависимость числа электронов
от их кинетической энергии (рис. 22.1.2).
Первый максимум при энергии электрона
54 эВ, условие максимума отражённых
электронов подчиняется условиям:
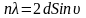 ,
где n
– порядок спектра. Эта же формула
справедлива для дифракции рентгеновских
лучей на кристаллах. Вывод: электроны
можно рассматривать как волны,
корпускулярность же подразумевает
неделимость электронов. Волновые
свойства частиц наиболее чётко
проявляются, когда энергия и импульс
сопоставимы с h.
В случае макротел волновыми свойствами
можно пренебречь.
,
где n
– порядок спектра. Эта же формула
справедлива для дифракции рентгеновских
лучей на кристаллах. Вывод: электроны
можно рассматривать как волны,
корпускулярность же подразумевает
неделимость электронов. Волновые
свойства частиц наиболее чётко
проявляются, когда энергия и импульс
сопоставимы с h.
В случае макротел волновыми свойствами
можно пренебречь.
<
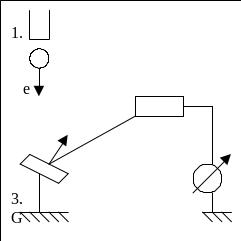
1.- электроная пушка;
2.- приемник е- ;
3.- пластина Ni.

54 108 162 Ек,эВ
<Вторая версия того же>>
В начале xx века была признана двойственная корпускулярно-волновая природа света.
Луи де Бройль выдвинул гипотезу, что дуализм не является свойством только оптических явлений, а имеет универсальный смысл.
Корпускулярная точка зрения Е=mc2 .Волновая точка зрения Е=h . mc2=h , m=h/c2- масса фотона
импульс р=mc= h/c длина волны де Бройля h/р Ек = mc22= р2/2m; p=2m Ек , =h/2m Ек = h/2me = 12,2510-10, (м).
Экспериментальное подтверждение формулы де Бройля: опыты Дэвисона и Джеремера (1927г.).
С классической точки зрения ожидается, что е - будут рассеиваться по законам геометрической оптики.
Однако устанавливается четкая зависимость числа отраженных электронов от их кинетической энергии.
