
- •2. Плавление и отвердевание кристаллических тел и объяснение этих процессов на основе представлений о дискретном строении вещества. Удельная теплота плавления.
- •Уравнение Теплового Баланса. Первый Закон Термодинамики
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в одноатомных идеальных газах
- •Первый закон Ньютона
- •[Править] Современная формулировка
- •Второй закон Ньютона
- •[Править] Современная формулировка
- •Третий закон Ньютона
- •[Править] Современная формулировка
- •2. Проводники в электростатическом поле. Диэлектрики в электрическом поле. Поляризация диэлектриков. Проводники в электрическом поле.
- •И деальный газ оказывает на стенки сосуда давление 1,01•105 Па. Тепловая скорость движения молекул 500 м/с. Найдите плотность газа.
- •1. Сила упругости. Закон Гука. Силы трения. Силы упругости
- •Закон Гука
- •2. Потенциальность электростатического поля. Потенциал и разность потенциалов.
- •Найти максимальную высоту, на которую поднимется камень, брошенный вертикально вверх со скоростью 20 м/с?
- •1. Импульс. Закон сохранения импульса. Реактивное движение.
- •2. Электроемкость. Конденсаторы. Энергия электрического поля конденсатора.
- •3. Шар массой 1 кг, летящий со скоростью 4 м/с, при ударе сжимает пружину. Найти максимальную энергию сжатия пружины.
- •1. Работа силы. Кинетическая энергия. Потенциальная энергия. Закон сохранения механической энергии. Работа силы (сил) над одной точкой
- •Работа силы (сил) над системой или неточечным телом
- •2. Сила тока. Закон Ома для участка цепи.
- •1. Статика. Момент силы. Условия равновесия твердого тела.
- •2. Сопротивление. Электрические цепи.
- •1. Возникновение атомистической гипотезы строения вещества и ее экспериментальные доказательства. Размеры и масса молекул. Количество вещества. Моль. Постоянная Авогадро.
- •Возрождение и раннее Новое время
- •2. Последовательное и параллельное соединения проводников.
- •[Править] Катушка индуктивности
- •[Править] Электрический конденсатор
- •[Править] Мемристоры
- •3. Через какой промежуток времени с момента старта мотоциклист, двигаясь с постоянным ускорением 5 м/с2 , разовьет скорость 90 км/ч?
- •1. Броуновское движение. Силы взаимодействия молекул. Строение газообразных, жидких и твердых тел. Тепловое движение молекул.
- •Построение классической теории
- •2. Основное уравнение мкт. Давление идеального газа. Связь давления и температуры.
- •3. Резистор сопротивлением r подключен к параллельно соединенным батареям с эдс 1и 2 и внутренними сопротивлениями соответственно r1 и r2. Определить ток, текущий через нагрузку.
- •1. Модель идеального газа. Границы применимости модели. Основное уравнение молекулярно-кинетической теории газа.
- •2. Работа и мощность тока. Электродвижущая сила. Закон Ома для полной цепи.
- •Эдс индукции
- •2. Электрический ток в металлах.
- •3. Напряженность поля в точке а направлена на восток и равна 2 • 105 н/Кл. Какая сила и в каком направлении будет действовать на заряд -3 мкКл?
- •1. Внутренняя энергия. Работа в термодинамике. Количество теплоты. Теплоемкость.
- •Работа в термодинамике
- •2. Зависимость сопротивления от температуры.
- •3. Сила взаимодействия двух одинаковых точечных зарядов, находящихся на расстоянии 0,5 м, равна 3,6 н. Найдите значения этих зарядов.
- •1. Первый закон термодинамики. Изопроцессы. Изотермы Ван-дер-Ваальса. Адиабатный процесс.
- •2. Сверхпроводимость.
- •1. Второй закон термодинамики: статистическое истолкование необратимости процессов в природе. Порядок и хаос.
- •2. . Собственная и примесная проводимости полупроводников, p— n переход. Полупроводниковый диод.
- •1. Тепловые двигатели: двигатель внутреннего сгорания, дизель. Холодильник: устройство и принцип действия. Кпд двигателей. Проблемы энергетики и охраны окружающей среды.
- •2. Транзистор.
- •3. Два шара массами 1 и 2 кг, скользят по гладкой поверхности на запад и север со скоростями 10 и 5 м/с соответственно. Определить направление и модуль импульса системы шаров.
- •2. Электрический ток в жидкостях.
- •1. Влажность воздуха. Кристаллические и аморфные тела. Модели строения твердых тел.
- •2. Электрический ток в вакууме. Электрический ток в газах. Плазма.
2. Электрический ток в жидкостях.
Жидкости по степени электропроводности делятся на: диэлектрики (дистиллированная вода), проводники (электролиты), полупроводники (расплавленный селен).
Электролит - это проводящая жидкость (растворы кислот , щелочей, солей и расплавленные соли).
Электролитическая диссоциация (разъединение) - при растворении в результате теплового движения происходят столкновения молекул растворителя и нейтральных молекул электролита. Молекулы распадаются на положительные и отрицательные ионы. Например, растворение медного купороса в воде.
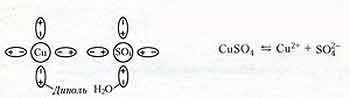
Ион - атом или молекула, потерявшая или присоединившая к себе один или несколько электронов; - существуют положительные ( катионы ) и отрицательные ( анионы ) ионы.
Рекомбинация ионов Наряду с диссоциацией в электролите одновременно может происходить процесс восстановления ионов в нейтральные молекулы.
Между процессами электролитической диссоциации и рекомбинации при неизменных условиях устанавливается динамическое равновесие.
Степень диссоциации - доля молекул, распавшихся на ионы; - возрастает с увеличением температуры; - еще зависит от концентрации раствора и от электрических свойств растворителя.
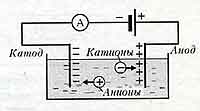
Электропроводимость электролитов Ионная проводимость - упорядоченное движение ионов под действием внешнего эл.поля; существует в электролитах; прохождение эл.тока связано с переносом вещества.
Электронная проводимость - также в небольшой мере присутствует в электролитах , но в основном характеризует электропроводимость жидких металлов. Ионы в электролите движутся хаотически до тех пор, пока в жидкость не опускаются электроды, между которыми существует разность потенциалов. Тогда на хаотическое движение ионов накладывается их упорядоченное движение к соответствующим электродам и в электролите возникает эл. ток.
Зависимость
сопротивления электролита от
температуры
Температурная
зависимость сопротивления электролита
объясняется в основном
изменением
удельного сопротивления.
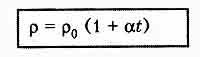 ,
где
альфа - температурный коэффициент
сопротивления.
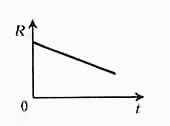
Для электролитов
всегда
,
где
альфа - температурный коэффициент
сопротивления.
Для электролитов
всегда
![]()
Поэтому
 Сопротивление
электролита можно рассчитать по
формуле:
Сопротивление
электролита можно рассчитать по
формуле:
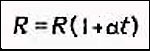
Явление электролиза - сопровождает прохождение эл.тока через жидкость; - это выделение на электродах веществ, входящих в электролиты; Положительно заряженные анионы под действием электрического поля стремятся к отрицательному катоду, а отрицательно заряженные катионы - к положительному аноду. На аноде отрицательные ионы отдают лишние электроны ( окислительная реакция ) На катоде положительные ионы получают недостающие электроны ( восстановительная реакция ).
Закон
электролиза
1833г.
- Фарадей
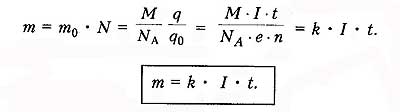 Закон
электролиза определяет массу вещества,
выделяемого на электроде при электролизе
за время прохождения эл.тока .
Закон
электролиза определяет массу вещества,
выделяемого на электроде при электролизе
за время прохождения эл.тока .
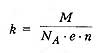 k
- электрохимический эквивалент вещества,
численно равный массе вещества,
выделившегося на электроде при прохождении
через электролит заряда в 1 Кл.
Зная
массу выделившегося вещества, можно
определить заряд электрона.
k
- электрохимический эквивалент вещества,
численно равный массе вещества,
выделившегося на электроде при прохождении
через электролит заряда в 1 Кл.
Зная
массу выделившегося вещества, можно
определить заряд электрона.

Применение электролиза получение чистых металлов (очистка от примесей); гальваностегия, т.е. получение покрытий на металле ( никелирование, хромирование и т.д. ); гальванопластика, т.е. получение отслаиваемых покрытий ( рельефных копий).
3. Плоский конденсатор заполнили диэлектриком и на пластины подали некоторую разность потенциалов. Энергия конденсатора при этом равна W = 2*10-5 Дж. После того, как конденсатор отключили от источника, диэлектрик вынули из конденсатора. Работа, которую надо было совершить для этого, равна А = 7*10-5 Дж. Найдите диэлектрическую проницаемость диэлектрика.
Билет №20
