
Лекция 14 Адсорбционная очистка газов
Одним из перспективных методов санитарной очистки газов, обеспечивающих высокую степень извлечения примесей, является адсорбционный. В процессе разделения, основанном на способности некоторых твердых тел избирательно поглощать газообразные компоненты из газовых смесей, присутствующие в газовой смеси молекулы загрязненного газа или пара сорбируются на поверхности или в порах твердого материала. Поглощаемое из газовой фазы вещество называется адсорбтивом, а твердое вещество, на поверхности или в порах которого происходит адсорбция поглощаемого веществе,— адсорбентом. Газовая фаза, в которой находится извлекаемый компонент, называется газом-носителем, а после того, как извлеченный компонент перешел в адсорбированное состояние, его называют адсорбатом.
Применение адсорбционных методов очистки газов целесообразно в тех случаях, когда требуемый эффект не может быть достигнут другими методами, концентрация удаляемой примеси в газе-носителе очень мала и когда требуется гарантированная рекуперация извлекаемой примеси из-за ее значительной стоимости.
В процессе адсорбции из отходящих газов удаляют различные примеси, в том числе: сернистые соединения, парообразные и газообразные углеводороды, хлор, сероводород, сероуглерод и многие другие вещества.
Явление адсорбции обусловлено наличием сил притяжения между молекулами адсорбента и адсорбтива на границе раздела соприкасающихся фаз. Процесс перехода молекул адсорбтива из газа-носителя на поверхностный слой адсорбента происходит в том случае, если силы притяжения адсорбента превосходят силы притяжения, действующие на адсорбтив со стороны молекул газа-носителя.
Рассмотрим схему кристаллической решетки твердого тела (рисунок 14.1). Атом «А», находящийся внутри кристалла, имеет шесть ближайших соседей, все его связи задействованы, и он не обладает свободной энергией. У атома «Б», находящегося на поверхности кристалла, только пять ближайших соседей, он имеет одну условную свободную связь и поэтому обладает большей энергией и находится в более высоком энергетическом состоянии, чем атом внутри кристалла. Еще большей энергией обладает атом «В», находящийся на грани кристалла. У него четыре ближайших соседа (две условные свободные связи) и, следовательно, большой избыток энергии. Самым большим избытком энергии обладает атом «Г», лежащий на вершине кристалла. У него всего три ближайших соседа (и три условные свободные связи). Этот избыток энергии называется поверхностной и она является причиной адсорбции.
Молекулы адсорбированного вещества, переходя на поверхность адсорбента, уменьшают его энергию, в результате чего происходит выделение теплоты. Теплота физической адсорбции сравнительно невелика и составляет до 60 кДж/моль.
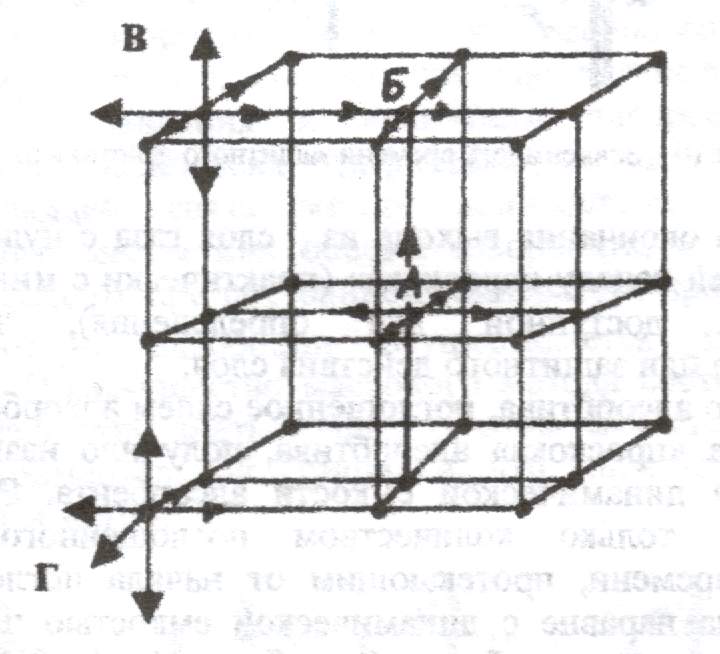
Рис.14.1. Схема кристаллической решетки адсорбента.
Силы притяжения адсорбента могут иметь различную природу — физическую или химическую. В соответствии с этим различают физическую и химическую адсорбцию. При физической адсорбции взаимодействие молекул с поверхностью адсорбента определяется сравнительно слабыми силами притяжения между атомами или молекулами при их сближении. При этом адсорбированные молекулы не вступают с молекулами адсорбента в химическое взаимодействие и сохраняют свою индивидуальность. Для физической адсорбции характерна высокая скорость, малая прочность связи между поверхностью адсорбента и адсорбтивом и малая теплота адсорбции. С повышением температуры количество физически адсорбированного вещества уменьшается, а увеличение давления приводит к возрастанию величины адсорбции.
Преимуществом физической сорбции является легкая обратимость процесса. При уменьшении давления адсорбента в газовой смеси либо при увеличении температуры адсорбированные молекулы легко десорбируются без изменения химического состава, а регенерированный адсорбент может использоваться многократно.
Высокая скорость физической адсорбции и способность адсорбентов к регенерации позволяет вести процесс циклично в условиях обратимости, т.е. с чередованием стадий поглощения и выделения извлекаемых компонентов. В основе химической адсорбции лежит химическое взаимодействие между адсорбентом и адсорбируемым веществом. Действующие при этом силы значительно больше, чем при физической адсорбции, а высвобождающееся тепло совладает с теплом химической реакции. Как правило, она колеблется в пределах от 20 до 400 кДж/моль. Важное отличие химической адсорбции: молекулы адсорбтива, вступив в химическое взаимодействие, прочно удерживаются на поверхности и в порах адсорбента. Характерной особенностью химической адсорбции является и то, что скорость ее при низких температурах мала, но возрастает с ростом температуры.
