
- •1. Строение, свойства и классификация полимеров
- •1.1. Строение, химические связи и классификация полимеров[1]
- •1.3. Полупроводниковые и проводящие полимеры
- •1.4 Электрические свойства полимеров
- •2. Материалы на основе полимеров
- •2.1. Проводящие полимеры[4]
- •2.2. Светоизлучающие диоды
- •2.3. Системы отображения информации
- •2.4. Полимерные транзисторы [6]
- •2.5. Спиновые полимерные транзисторы
- •2.6. Печать пластиковых транзисторов
- •2.7. Бумажный транзистор
- •2.8. Биотранзистор и биопротонный транзистор
- •2.8.1. Биотранзистор
- •2.8.2. Биопротонный транзистор[11]
- •2.9. Полимерные пленки
- •3. Поливиниловый спирт
- •9.6.8. Поливиниловый спирт («Полимерные пленки» е.М.Абдель-Бари пер.С англ. Под ред. Г.Е.Заикова изд-во Профессия Спб 2006г.)
- •3. Белки
- •3.1. Пространственные конформации белковых молекул [14].
- •3.2. Фазовый переход «глобула – клубок».
- •4. Диэлектрическая проницаемость и поляризуемость полимеров
- •4.1. Диэлектрическая проницаемость[20]
- •4.2. Явление диэлектрической поляризации
- •Список литературы
- •Оглавление
- •1. Строение, свойства и классификация полимеров
- •1.1. Строение, химические связи и классификация полимеров
- •1.2. Особенности физических свойств полимеров
3. Поливиниловый спирт
Поливиниловый спирт представляет собой полимерное соединение, которое не может быть получено полимеризацией соответствующего мономера – винилового спирта, не существующего в свободном состоянии.
Поливиниловый спирт впервые был получен Германом и Генелем в 1924 году при омылении раствора поливинилацетата в этиловом спирте едким калием.
В промышленности поливиниловый спирт получается омылением поливинилацетата в присутствии как щелочного, так и кислого катализатора.
9.6.8. Поливиниловый спирт («Полимерные пленки» е.М.Абдель-Бари пер.С англ. Под ред. Г.Е.Заикова изд-во Профессия Спб 2006г.)
Пленки из поливинилового спирта (ПВС) уникальны во многих отношениях.
Полимер получают гидролизом (точнее говоря, алкоголизом) поливинилацетата.
Будучи полностью гидролизованным, он легко растворяется в воде. Контролируя
степень гидролиза, можно приготовить пленки, которые будут растворимы
в горячей, но не в холодной воде. Поскольку ПВС деградирует при температурах
значительно ниже температуры плавления, его нельзя получить экструзией.
Поэтому для получения пленки ее высаживают из водного раствора. Пленка аморфная,
однако ориентация приводит к появлению некоторой кристалличности.
Растворимость в воде позволяет пленкам из ПВС занять свою нишу на рынке,
поскольку в некоторых приложениях это желательное свойство. Одно из применений
— внутренний мешок при упаковке сельскохозяйственных и прочих
химикалий. Такой мешок можно поместить в аппарат для растворения и дозировки
без непосредственного контакта человека с его содержимым. В воде мешок
растворяется и химикалии высвобождаются. Растворенный полимер не засоряет
сопла распылителя и является биоразлагаемым.
Другая область применения связана с больничными мешками для белья. Здесь
используется вариант полимера, растворимого в горячей воде. Грязное белье
загружается в мешки, которые затем помещаются в стиральную машину, исключая
контакт зараженного белья с персоналом. Поскольку полимер не растворяется
в холодной воде, он не будет поврежден остаточной жидкостью, содержащейся
в белье; в горячей воде мешки легко растворятся.
3. Белки
3.1. Пространственные конформации белковых молекул [14].
Белки — биологические полимеры, а именно полимеры α-аминокислот, то есть полипептидные (образованные пептидными связями NH–CO) цепи, содержащие в качестве боковых радикалов аминокислотные остатки. Химическая формула белка в растворе:
NH3+ – CHR – CO – (NH – CHR – CO)n – NH – CHR – COO-
Здесь R — любые из 20 аминокислотных остатков. В построении всех известных науке белков участвуют 20 аминокислот, и многообразие белков в живой природе определяется огромным количеством вариантов цепей из этих аминокислот. Последовательность аминокислот в цепи белка — его первичная структура, и именно она определяет основные свойства и функции белка. Первичная структура записана в генетическом коде и реализуется в процессе биосинтеза. К вторичным структурам белков относят так называемые α-спирали и β-складки, причем для образования вторичных структур требуются взаимодействия (за счет образования водородных связей) относительно близких вдоль цепи звеньев. Третичная структура белков — способ расположения в пространстве цепи как целого, то есть способ размещения элементов вторичной структуры. Принципиальное отличие третичной структуры от вторичной в том, что при ее формировании возможно сближение любых, сколь угодно отдаленных по цепи, звеньев. Глобула, некое подобие комка из белковой цепи, — типичный пример третичной структуры. Большинство белков крови — транспортные, и в нативном состоянии глобулярны [15, 16]. Четвертичная структура белка возникает в результате ассоциации нескольких глобул, или субъединиц, с образованием составной глобулы.
Другая, принципиально отличная от глобулы, конформация полимерной цепи, в том числе полипептидной, — статистический, или гауссов, клубок.
Полимерный клубок, возникающий из макромолекулы вследствие тепловых флуктуаций — поворотов вокруг единичных связей — является рыхлым образованием. Это означает, что собственно полимерная цепь занимает ничтожно малую долю объема, занимаемого в пространстве клубком. На рис 3.1 показана полученная в модельном эксперименте на ЭВМ типичная конформация свободно-сочлененной цепи из 626 звеньев [17].
Кроме того, клубок обладает следующими свойствами: корреляция направления звеньев вдоль цепи убывает по экспоненциальному закону (распределена по закону Гаусса, поэтому клубок называют также гауссовым) и флуктуации размера клубка в процессе теплового движения имеют порядок размера самого клубка. Собственная гибкость макромолекулы, зависящая от химического строения, определяет длину участка полимерной цепи, вдоль которого сохраняется линейная память, или корреляция направления звеньев. Эта длина называется персистентной длиной, или эффективной гибкостью. Размер клубка зависит от персистентной длины и от количества звеньев цепи (пропорционален квадратному корню из числа звеньев).
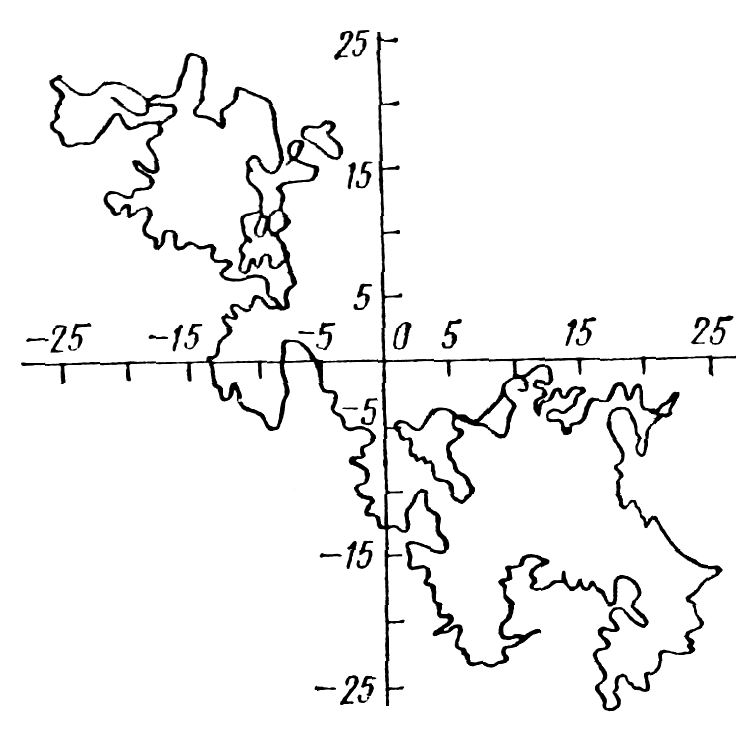
Рис. 3.1. Клубковая конформация свободно-сочлененной цепи (единица измерения — длина одного звена, всего в представленной макромолекуле 626 звеньев).
Взаимодействия звеньев в клубке сходны с взаимодействиями молекул в реальном газе: сильное отталкивание на малых расстояниях и тем самым невозможность нахождения двух мономерных звеньев в одном и том же месте и слабое притяжение на больших расстояниях. Для характеристики действия этих сил вводится понятие «θ-температура»: температура, при которой в данном растворителе силы притяжения полностью компенсируются силами отталкивания, и объемные эффекты отсутствуют. При T > θ доминирует отталкивание (ситуация хорошего растворителя), при Т < θ — притяжение (ситуация плохого растворителя). Клубок в хорошем растворителе набухает и сжимается в плохом. Такое представление поведения макромолекулы в растворе получило название теории Флори[18], а θ-температура называется также температурой Флори.
Если между звеньями цепи реализуется сильное притяжение при Т < θ или на клубок действует внешнее сжимающее поле, то он «схлопывается» в компактную структуру — в глобулу. Этот процесс до некоторой степени сходен с конденсацией газа в жидкость. В глобуле флуктуации локальной концентрации звеньев малы по сравнению с самой концентрацией, а радиус корреляции флуктуации концентрации много меньше размеров макромолекулы. На рис.3.2 показана типичная глобулярная конформация свободно сочлененной цепи, состоящей из 626 звеньев с длиной звена 1 [19]. Рис. 3.2. следует сравнить с рис. 3.1.
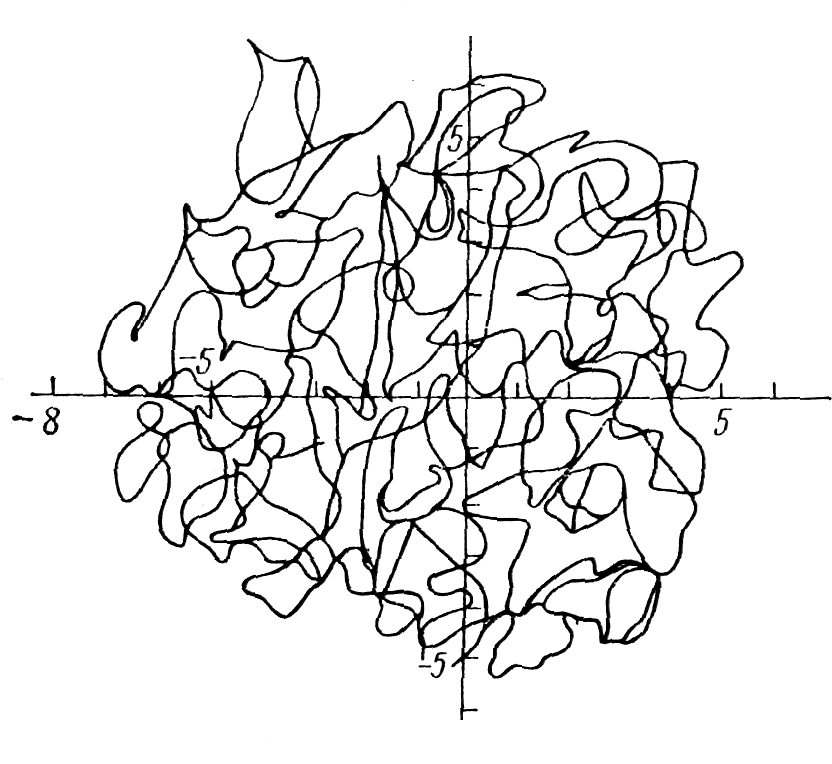
Рис. 3.2. Глобулярная конформация свободно-сочлененной цепи.
Белковая глобула — один из самых сложных объектов физики. Особенность белковой глобулы заключается в наличии строго определенной пространственной третичной структуры. Обычная полимерная глобула является слабофлуктуирующей системой, причем слабо (на величины, много меньшие средних значений) флуктуируют размер или плотность глобулы. Структура белковой глобулы зафиксирована, и слабофлуктуирующими являются координаты большинства атомов в белковой цепи. Кроме того, все надмолекулярные структуры белковой глобулы определяются ее первичной структурой, то есть аминокислотной последовательностью. При этом третичная структура обладает свойством самоорганизации, иначе говоря, цепочка с определенной последовательностью звеньев, если ее предоставить самой себе в подходящих условиях, всегда сворачивается одинаково. Для «обычного» природного или синтетического полимера, все звенья цепи которого одинаковы, понятие самоорганизации лишено смысла, для таких полимеров говорят только о существовании «памяти» о направлении цепи, или о корреляциях между пространственным расположением звеньев.
Поскольку самоорганизация иногда, в мягких условиях, наблюдается как ренатурация, или процесс, обратный денатурации, то для выяснения природы самоорганизации физиками было проведено много работ по изучению процесса денатурации. В 1982 г. наконец, было показано, что денатурация имеет характер не перехода глобула – клубок, то есть не разворачивания глобулы, а перехода нативная глобула – расплавленная глобула. При этом переходе блоки вторичной структуры, оставаясь жесткими, немного раздвигаются, так что боковые аминокислотные группы приобретают некоторую свободу движения, но глобула остается стабильной, поскольку появившиеся «щели» все же недостаточны для проникновения молекул растворителя (воды). Однако биологическая функция при этом уже утрачивается (лишь в редких случаях, возможно, ее восстановление при ренатурации). Дальнейшее воздействие на белок может привести к разворачиванию глобул и к разрушению вторичных структур, и в конечном итоге даже к образованию статистического клубка.
