
- •Основы современного естествознания введение
- •Раздел 1. Тематический план дисциплины
- •Раздел 2.
- •Краткий курс лекций
- •Лекция 1.
- •Естествознание в мировой культуре
- •1. Предмет, задачи, структура курса «Основы современного естествознания».
- •2. Естествознание в системе форм общественного сознания.
- •3. Философия, математика, гуманитарные и естественные науки и их объекты
- •4. Естественнонаучная и гуманитарная культуры. Специфика и взаимосвязь естественнонаучного и гуманитарного типов культур
- •5. Проблема постнеклассического межкультурного диалога естественных и гуманитарных наук
- •Лекция 2. Особенности физического описания реальности Современные представления о движении, пространстве и времени.
- •1. Идеальные образы объектов реального мира (твердое тело, материальная точка, частица, вакуум, среда, поле, вихрь, волна)
- •2. Физические характеристики идеальных объектов и представление о способах их описания ( масса; заряды и их действие на расстоянии; заряды как источники полей; «свободные» поля, суперпозиция полей)
- •3. Единицы физических величин
- •Лекция 3. Современные представления о движении, пространстве и времени
- •1. Движение и его виды. Относительность движения
- •2. Законы сохранения и их роль в формировании научной картины мира (законы сохранения энергии, импульса и момента импульса)
- •3. Пространство и время как основные свойства материи
- •Лекция 4. Понятие теплоты и термодинамический способ описания действительности
- •1. Термодинамические системы и их макроскопические храктеристики
- •2. Теплота и механическая работа (закон сохранения энергии)
- •3. Обратимые и необратимые процессы. Равновесное состояние и флуктуации. Закон возрастания энтропии
- •4. Неравновесные системы и их характеристики
- •Реакция Белоусова-Жаботинского
- •5. Бифуркации и аттракторы. Спонтанная самоорганизация в природе и обществе
- •Лекция 5. Квантовые представления о строении вещества и физическая Вселенная
- •1. Квантовые представления о строении вещества (фотоэффект и эффект Комптона, опыты по дифракции электронов и фотонов).
- •2. Современные представления о строении атома (волновые свойства атомов и молекул; лазерное излучение)
- •3. Соотношение неопределенностей и квантово-волновой дуализм
- •4. Представление об элементарных частицах и их взаимодействии. Ядерные взаимодействия. Атомная и термоядерная энергетика
- •5. Квантовая инженерия в наномире
- •Лекция 6. Элементарные частицы и физический эксперимент
- •1. Современные ускорители
- •2. Рождение и аннигиляция элементарных частиц
- •3. Виды взаимодействий элементарных частиц
- •4. Теория кварков
- •Лекция 7. Элементы современной космологии (физическая Вселенная)
- •1. Космические объекты и методы их исследования
- •2. Солнечная система в мире галактик
- •3. Модель Большого взрыва
- •4. Звезды и их эволюция
- •5. Земля в свете антропного принципа
- •Геохронологическая и стратиграфическая шкалы
- •Географическая оболочка Земли
- •Лекция 8. Система современного химического знания
- •1. Химия как наука, современная химическая картина мира (структурные уровни организации материи с точки зрения химии).
- •2. Основные понятия и законы химии (периодический закон и его значение)
- •3. Классификация химических веществ
- •§ 2. Теория строения органических соединений
- •§ 3. Классификация органических соединений
- •§ 4. Высокомолекулярные соединения (полимеры)
- •4. Теория химического строения вещества. Взаимосвязь между строением, свойствами и реакционной способностью вещества
- •Лекция 9. Растворы. Химическая идентификация
- •1. Растворы и их особенности
- •2. Химическая идентификация
- •3. Химические процессы (реакции)
- •4. Химия экстремальных состояний
- •Лекция 10. Современная химия: экономический и социальный аспекты
- •1. Масштабы современного химического производства
- •2. Проблемы сырьевых ресурсов и химия
- •Металлы и их коррозия
- •3. Химические процессы и материалы (традиционные материалы - дерево, стекло, керамика; применение металлов и сплавов, силикатных материалов, полимеров, биологически активных веществ)
- •6.11. Традиционные материалы с новыми свойствами
- •Синтетические материалы.
- •4. Материалы для создания носителей информации. Химия и нанотехнологии
- •5. Химико-энергетические процессы в природе и технике (альтернативные виды топлива, «зеленая химия»)
- •Аккумуляторы для сотовых телефонов. Эффект памяти
- •А теперь подведем итоги.
- •Лекция 11. Роль химии в современном обществе
- •1. Экологические и социальные аспекты химии
- •2. Проблема переработки вторичных ресурсов
- •3. Химия и окружающая среда
- •4. Защита биосферы от химических загрязнений
- •5. Роль химии в решении проблем устойчивого развития цивилизации
- •Лекция 12. Особенности современного биологического знания и его эволюция
- •1. Биология как наука и особенности биологического познания мира
- •2. Фундаментальные и частные биологические теории
- •3. Традиционный, физико-химический, эволюционный и биоинженерный периоды развития биологии. Основные достижения биологии в эти периоды
- •4. Генетическая революция в биологии
- •5. Синергетическая теория эволюции (глобальная эволюция)
- •6. Этические проблемы современной биологии
- •Лекция 13. Современные концепции происхождения и сущности жизни
- •1. Феномен жизни и его исследование
- •2. Отличительные особенности живой и неживой материи
- •3. Основные концепции происхождения жизни
- •5. Идея трансформации биосферы в ноосферу и глобальный эволюционизм
- •Лекция 14. Концепция структурных уровней организации живой материи
- •1. Уровни организации живой природы: молекулярно-генетический, онтогенетический, надорганизменный (популяционно-видовой), популяционно-биоценотический (биогеоценотический)
- •2. Биосферный уровень организации живой материи
- •3. В.И. Вернадский о роли «живого вещества»
- •4. Материальные основы появления жизни на Земле
- •Концепция происхождения живого по гипотезе Опарина-Холдейна
- •5. Возникновение и роль многоклеточных организмов в формировании биосферы Земли Лекция 15. Человек, его место и роль в едином социоприродном комплексе
- •1. Человек как единство биологического, социального и духовного. Генезис человека
- •2. Факторы, закономерности и этапы антропосоциогенеза
- •3. Культура как фактор регуляции (агрессии) человека
- •4. Социобиология и проблема геннокультурной коэволюции
- •5. Биологические предпосылки возникновения социальности человека. Роль социальных факторов в становлении человека
- •4. Перспективы исследования космобиосоциальной сущности человека в современной биологии
- •Биокатализ
- •Генные технологии
- •8 8. Проблемы клонирования
- •2. Достижения и возможные негативные последствия биотехнологий
- •3. Поиск путей развития общества, сохраняющих целостность природы Глава 11 гармония трудовой деятельности людей и природы
- •11.1. Обновление энергосистем
- •11.2. Промышленность, автотранспорт и окружающая среда
- •11.3. Города и природа
- •11.4. Решение проблем утилизации
- •11.5. Перспективные материалы, технологии и окружающая среда
- •4. Ресурсы биосферы и демографические проблемы
- •Лекция 17. Социальное измерение современного естествознания
- •1. Роль научного знания на современном этапе развития общества
- •2. Нелинейное освоение культурой результатов научной деятельности
- •3. Наука и сми
- •5.4. Экологические проблемы сегодня
- •4. Естествознание как основа современных технологий
- •5. Проблема моделирования социокультурных явлений
- •Раздел 3.
- •Семинар 2 . Взаимодействие естественнонаучного и гуманитарного знания
- •Семинар 4. Концепции термодинамики
- •Семинар 5 . Квантовые представления о строении вещества и физическая Вселенная
- •Семинар 6 . Элементарные частицы и физический эксперимент
- •Семинар 7 . Элементы современной космологии (физическая вселенная)
- •Раздел 2. Химия в контексте устойчивого развития общества Семинар 8. Система современного химического знания
- •Семинар 9 . Растворы. Химическая идентификация
- •Семинар 10. Современная химия: экономический и социальный аспекты
- •Семинар 11. Роль химии в современном обществе
- •Раздел 3. Специфика, структура и проблемное поле современного биологического познания Семинар 12 . Особенности современного биологического знания и его эволюции
- •Семинар 13 . Современные концепции происхождения и сущности жизни
- •Семинар 14. Концепция структурных уровней организации живой материи
- •Семинар 15. Человек, его место и роль в едином социоприродном комплексе
- •Семинар 16 . Социальный аспект биологического познания
- •Заключение. Социальное измерение современного естествознания Семинар 17. Перспективы развития естествознания и гуманитарных наук в 21 веке
- •3.2. Перечень вопросов к экзамену (зачету)
- •3.3. Учебно-методические материалы по дисциплине
2. Проблемы сырьевых ресурсов и химия
Основными сырьевыми ресурсами для человечества и большинства современных производств являются вода, металлы, нефть, уголь, газ, минералы и др.
Вода – это наиболее распространенное вещество в природе. Более 70% общей поверхности земного шара занимают океаны и моря, остальная часть представляет собой сушу. Большое количество воды находится в атмосфере Земли в виде пара (около 12 · 103 км3 ).
В жизни планеты вода играет важную роль. Под действием воды изменяется поверхность планеты, формируется толща осадочных пород на дне океанов и морей.
Океаны представляют собой огромный источник минеральных и биологических ресурсов. Морская вода содержит более 70 химических элементов периодической таблицы. Мировой океан является естественным терморегулятором планеты, аккумулируя и отдавая теплоты в зависимости от времени года. Обладая большой удельной теплоемкостью, вода, способна накапливать значительную энергию. Такая особенность воды существенно влияет на состояние климата.
Участвуя во многих биохимических процессах, вода служит основным фактором жизнедеятельности растительного и животного мира. Большинство живых организмов в своем составе имеют воду. Например, тело человека содержит около 60% воды, для поддержания ее баланса в организме необходимо 2-3 л в сутки для каждого индивида.
Потребление воды осуществляется не только в целях удовлетворения прямых физиологических потребностей, но и для различного рода сопутствующих и технологических процессов. Рост народонаселения также обостряет проблему водных ресурсов.
Мировой океан, имеющий объем 1,4 · 109 км 3, является естественным резервуаром для хранения запасов воды.
Морская вода содержит массу солей, в среднем около 37 г солей приходится на литр морской воды, что позволяет назвать ее соленой.
Пресная вода на Земле имеется в гораздо меньших количествах. От общего количества воды на поверхности Земли она составляет 2,5% (3,5 106 км3. Пресной называют воду, если она содержит не более 1г солей на 1 литр. Основной объем пресной воды сосредоточен в айсбергах и ледниковых покровах Арктики и Антарктики. Использование этих ресурсов связано с целым рядом глобальных проблем. Часть пресной воды (около 30%) сосредоточено под Землей. Часть пресной воды содержится в озерах и болотах, руслах рек. Из всех компонентом земной гидросферы именно вода рек является основным источником пресной воды для человека и животных. Вся биомасса Земли на 60-80% состоит из воды, а общий объем биологической воды равен 1,1 · 103 км3 .
Вся природная вода содержит примеси органического и минерального происхождения. Эти вещества поступают в воду разными путями: вымывание пород, осадки, продукты жизнедеятельности человека и животных. Таким образом природные воды представляют собой растворы, примеси в которых можно разделить на ряд групп: ионы; растворенные газы; биогенные вещества; микроэлементы; органические вещества (классификация О.А. Алекина). Наибольшее количество в воде присутствует ионов натрия, кальция, магния, калия, железа. Среди газов, растворенных в воде, присутствуют кислород, азот, водород, сероводород и др. Биогенными примесями считают соединения, с которыми связана жизнедеятельность живых организмов: различные формы азота, фосфора, кремния, железа и др. Микроэлементами называют примеси, находящиеся в растворе в количествах, не превышающих 10-3 %. В воде они представлены бромом, йодом, медью, кобальтом, никелем и др. химическими элементами. Органические соединения в виде различного рода растительных и животных организмов и продуктов их взаимодействия также широко представлены в воде.
Совокупность всех примесей обуславливает свойства и качество пресной воды. Для оценки состояния природных вод осуществляют физико-химический анализ, что позволяет сделать выводы ее пригодности для тех или иных целей.
Вода обладает уникальными свойствами. Она может находиться в трех агрегатных состояниях в зависимости от внешних условий. Для воды характерна диаграмма состояний, которая показывает зависимость фазовых переходов от давления и температуры. Кривая ОА называется кривой кипения и разделяет области жидкого и парообразного состояния воды. Кривая ОС называется кривой плавления и разделяет твердое и жидкое состояние воды. Третья кривая диаграммы ОВ – это кривая сублимации, разграничивающая твердое и парообразное состояние воды.
Вдоль названных кривых расположены точки, в которых разные фазы вещества находятся в состоянии равновесия. Точка О носит название тройной точки, она характеризует равновесие трех фаз воды.
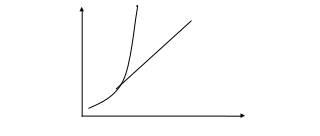
Диаграмма фазовых переходов воды.
Вода имеет специфическую особенность теплового расширения. Плотность воды при температуре 4 градуса Цельсия максимальна, поэтому в водоемах у дна вода всегда теплее, а ледяной покров меньшей плотности защищает живые организмы от переохлаждения.
Вода также обладает высоким поверхностным натяжением, что обуславливает капиллярные явления в живой и неживой природе. Значительная диэлектрическая проницаемость воды обеспечивает высокую растворимость веществ и образование широкого перечня растворов, большинство из которых содержат вещества, диссоцииорованные на ионы. Все аномальные свойства воды обусловлены ее структурой и способностью молекул воды образовывать молекулярные ассоциаты.
Вода состоит из молекул, образованным атомом кислорода и двумя атомами водорода с валентным углом 104о 31. Расстояние между ядрами кислорода и водорода составляют около 0,1 нм, а между ядрами атомов водорода – 0,15 нм. Из шести электронов, составляющих внешний электронный слой атома кислорода, два образуют ковалентные полярные связи О – Н, а остальные составляют две неподдельные пары. Общие электронные пары, образующие связи О –Н, смещены к кислороду, в результате чего атомы водорода приобретают эффективные положительные заряды (рис. ). Центры отрицательных зарядов общих электронных пар атома кислорода смещены относительно ядра атома, что приводит к возникновению двух отрицательных полюсов. Такое расположение зарядов делает молекулу воды полярной, а электрический дипольный момент равен 3,33 · 10 -30 Кл м. Эта особенность химической природы и объясняет аномальные свойства воды.
Если вода находится в парообразном состоянии, то ее молекулярная масса равна 18. Вода в жидкой фазе содержит не отдельно взятые молекулы, а их ассоциации, т.е. соединение молекул в более сложные агрегаты. Ассоциация молекул воды объясняется дополнительными водородными связями между молекулами.
В твердом состоянии молекулы воды располагаются слоями, между которыми существуют пустоты с размерами в пределах размеров самих молекул воды. Это объясняет уменьшение плотности льда, образующегося в процессе кристаллизации воды.
При нагревании воды часть тепла расходуется на разрушение водородных связей, энергия которых достигает 25 кДж/моль, что объясняет высокую теплоемкость воды. При температуре выше 20о С молекулы воды утрачивают сложные структуры и образуют димеры – парно расположенные молекулы.
В обычных условиях вода не проявляется окислительных и восстановительных свойств из-за высокой энергии связи молекул кислорода и водорода в молекуле. Поэтому молекулы воды имеют устойчивость к нагреванию. Разрушение молекул вода начинается лишь при температурах более 1000о С. Такой процесс называется термической диссоциацией. Согласно принципу Ле Шателье вода разлагается в большей степени с ростом температуры, однако эта зависимость не носит резкий характер.
Вода является химически активным веществом. При комнатных температурах вода вступает в реакцию с такими металлами как натрий, калий, кальций, барий и др. А при более высоких температурах она вступает в реакцию и смене активными металлами. С водой вступают в реакцию и активные неметаллы (фтор, хлор и др.) с образованием соответствующих кислот.
Существует несколько разновидностей воды, кроме обычной воды в нашем понимании. Такими видами являются тяжелая и сверхтяжелая вода. В состав первой входят атомы дейтерия, а торой – трития. Первые эксперименты по получению тяжелой воды были осуществлены в 1933 г., а сверхтяжелой в 1951 г. Данные виды воды используются в ядерных реакторах.
Учитывая количество изотопов водорода и кислорода, воду в природных условиях можно представить как сложное соединение 135 изотопных ее разновидностей. Однако основное количество представлено молекулой Н2О, что и определяет ее свойства в обычных условиях.
Для оценки качества воды ее подвергают физико-химическому анализу, что позволяет определить физические и химические показатели качества. К физическим показателям качества относятся температура, запах, вкус, прозрачность, мутность, плотность цветность и некоторые другие. В качестве химических показателей можно назвать наличие взвешенных веществ, сухого остатка, окисляемость, химическая потребность в кислороде, биологическая потребность в кислороде, хлороемкость, общая щелочность воды, жесткость, активная реакция среды (рН), наличие растворенного кислорода, наличие сероводорода, наличие диоксида углерода, наличие иода и др. элементов. Полный химический анализ воды позволяет получить достоверную информацию о качестве воды и возможности ее использования для различных целей. Особые требования предъявляются к питьевой воде. Одним из них является отсутствие бактерий и токсических элементов. Для питьевой воды вводятся определенные стандарты.
