
- •Глава 4. Патофизиология тошноты и рвоты 55
- •Глава 5. Патофизиология диареи 71
- •Глава 6. Мальабсорбция 105
- •Глава 7. Желтуха и нарушение функции печени 147
- •Глава 8. Панкреатиты 174
- •Глава 9. Кровотечение из желудочно-кишечного тракта 201
- •Глава 10. Опухоли желудочно-кишечного тракта 218
- •Введение
- •Проф.Джозеф м. Хендерсон Глава 1. Оценка и значение боли в животе
- •Клинический пример
- •Анатомия и физиология Висцеральные сенсорные пути
- •Стимулы абдоминальной боли
- •Теория входящего контроля боли
- •Клинические корреляции
- •Клиническая оценка и значение
- •Дифференциальный диагноз
- •Лечение
- •Глава 2. Дисфагия, боли в груди и гастроэзофагальный рефлюкс
- •Физиология глотания
- •Клинические корреляции пищеводной дисфункции
- •Клиническая оценка
- •Клинический случай
- •Вопрос 1. В данном случае эти расстройства глотания связаны с нарушениями функции глотки или пищевода?
- •Вопрос 2. Нарушен процесс глотания только твердой пищи или также и жидкой?
- •Вопрос 3. Что показало рентгенографическое исследование?
- •Вопрос 4. Что делать дальше?
- •Вопрос 5. Какой диагноз?
- •Вопрос 7. Как проводится такое лечение?
- •Глава 3. Язвенная болезнь
- •Патофизиология
- •Повреждающие факторы
- •Клинические корреляции
- •Признаки и симптомы
- •Дифференциальный диагноз
- •Терапия
- •Ингибиторы кислоты / Нейтрализующие препараты
- •Препараты, не влияющие на кислотность
- •Хирургическое лечение язвенной болезни
- •Синдром Золлингера-Эллисона
- •Клинические проявления
- •Локализация опухоли
- •Дифференциальная диагностика
- •Направления лечения
- •Клиническое обследование
- •Визуализация язвы
- •Исследование кислотности желудочного сока
- •Локализация опухоли при синдроме Золлингера-Эллисона
- •Клинический случай
- •Дифференциальная диагностика
- •Диагностический план
- •План лечения
- •Заключение
- •Глава 4. Патофизиология тошноты и рвоты
- •Терминология
- •Патофизиология
- •Акт рвоты
- •Метаболические последствия рвоты
- •Последствия повторных актов рвоты
- •Клинические корреляции
- •Функциональная непроходимость
- •Нарушение эвакуаторной функции желудка
- •Нарушение моторики тонкой кишки
- •Нарушения центральной нервной системы
- •Тошнота и рвота при беременности
- •Клиническое обследование
- •Оценка скорости опорожнения желудка
- •Манометрия
- •Электрогастрография
- •Клинический случай
- •Заключение
- •Глава 5. Патофизиология диареи
- •Патофизиология
- •Пассивный транспорт воды
- •Секреторные клетки
- •Пероральная регидратация
- •Наследственные нарушения электролитного транспорта
- •Диарея в клинике
- •Острая и хроническая диарея Острая диарея
- •Хроническая диарея
- •Осмотическая и секреторная диарея
- •Моторика
- •Диарея и колит, вызванные применением антибиотиков
- •Клиническая оценка Содержание электролитов в стуле
- •Перфузионное исследование тонкой кишки
- •Содержание жиров в стуле
- •Водородный дыхательный тест
- •Эндоскопическое исследование сигмовидной кишки
- •Исследование нейроэндокринной системы
- •Культуры микроорганизмов кала / Паразиты и их яйца
- •Клинический случай
- •Заключение
- •Глава 6. Мальабсорбция
- •Патофизиология Переваривание Жевание и слюноотделение
- •Кислота и пепсин желудка. Измельчение и перемешивание пищи
- •Секреция желчи
- •Панкреатическая секреция
- •Всасывание в кишечнике Общая физиология всасывания в кишечнике Кишечные ворсинки и микроворсинки
- •Основные механизмы всасывания и транспорта веществ
- •Частная физиология всасывания в кишечнике Всасывание воды и электролитов
- •Всасывание аминокислот
- •Всасывание углеводов
- •Всасывание жиров
- •Всасывание витаминов и минеральных веществ
- •Признаки и симптомы мальабсорбции
- •Снижение массы тела
- •Потеря белков
- •Дефицит витаминов
- •Клинические корреляции
- •Недостаточность желчных кислот Заболевания печени
- •Обструкция желчевыводящих путей
- •Дисбактериоз
- •Заболевания / Резекция подвздошной кишки
- •Нарушения функций желудка Постгастрэктомический синдром
- •Злокачественная анемия/Ахлоргидрия
- •Ваготомия
- •Патология слизистой оболочки кишечника Целиакия(спру)
- •Тропическая спру
- •Ишемическая энтеропатия
- •Лучевая(радиационная)энтеропатия
- •Другие заболевания Непереносимость лактозы
- •Синдром короткой кишки
- •Протеинтеряющая энтеропатия
- •Клинические тесты
- •Анализы крови
- •Выявление жира в стуле
- •Водородный дыхательный тест
- •Рентгенологическое исследование тонкой кишки
- •Биопсия тонкой кишки
- •Тест Шиллинга
- •Дыхательный тест для оценки содержания желчных кислот
- •Оценка 1-антитрипсина в кале
- •Клинический пример
- •Заключение
- •Глава 7. Желтуха и нарушение функции печени
- •Введение
- •Патофизиология
- •Метаболизм лекарств
- •Лабораторные тесты
- •Маркеры холестаза
- •Оценка синтетической функции печени
- •Клинические корреляции
- •Гемохроматоз
- •Болезнь Вильсона
- •Дефицит 1-антитрипсина
- •Аутоиммунный хронический активный гепатит
- •Алкогольный гепатит
- •Повреждение печени лекарственными препаратами
- •Холестатические синдромы Первичный билиарный цирроз
- •Первичный склерозирующий холангит
- •Инфильтративные процессы
- •Клинический пример
- •Заключение
- •Глава 8. Панкреатиты
- •Анатомия Эмбриология
- •Иннервация, кровоснабжение и лимфоотток
- •Физиология
- •Экзокринная функция
- •Секреция жидкости и электролитов
- •Синтез и секреция ферментов
- •Амилаза
- •Протеазы
- •Стимуляторы панкреатической секреции
- •Фазы пищеварения
- •Ингибиторы секреции поджелудочной железы
- •Клинические корреляции Острый панкреатит Клиническая картина
- •Этиология и патофизиология
- •Хронический панкреатит Клиника
- •Этиология и патофизиология
- •Клинические тесты Тесты со стимуляцией
- •Бентирамидный тест
- •Клинический пример
- •Заключение
- •Глава 9. Кровотечение из желудочно-кишечного тракта
- •Особенности кровоснабжения желудочно-кишечного тракта
- •Микроциркуляция
- •Ишемия внутренних органов
- •Острые и хронические кровотечения из желудочно-кишечного тракта
- •Портальная гипертензия
- •Принципы лечения кровотечения из желудочно-кишечного тракта при портальной гипертензии
- •Локализация кровотечения
- •Прогноз при кровотечениях из верхних отделов желудочно-кишечного тракта
- •Кровотечение при язвенной болезни желудка как пример кровотечения из верхних отделов желудочно-кишечного тракта
- •Кровотечение из дивертикула
- •Сосудистая эктазия как пример хронического кровотечения из желудочно-кишечного тракта
- •Диагностика кровотечений из желудочно-кишечного тракта
- •Клинический пример
- •Дифференциальный диагноз
- •Заключение
- •Глава 10. Опухоли желудочно-кишечного тракта
- •Пролиферация и дифференцировка эпителия
- •Канцерогенез
- •Теории образования опухолей
- •Развитие опухоли
- •Специфические локализации рака
- •Рак желудка
- •Питание и рак желудочно-кишечного тракта Рак поперечно-ободочной и прямой кишки
- •Рак желудка
- •Роль воспаления в возникновении рака желудка Хронический атрофический гастрит и Helicobacter pylori
- •Рак и воспалительные заболевания кишечника
- •Скрининговые тесты при раке толстой кишки
- •Исследование стула на скрытую кровь
- •Возможности скрининговых исследований по поводу рака толстой кишки в XXI столетии— генетический подход
- •Клинический пример
Секреторные клетки
Транспортные белки в секреторных клетках отличаются от транспортных белков в клетках ворсинок (рис. 5-6). Содержание Na+ в клетках регулируется белками базолатерального участка мембраны, в то время как проницаемость для Na+ в апикальных отделах клеток относительно мала. Натрий поступает в клетку через базолатеральный участок мембраны посредством механизма сочетанного транспорта; в каждом цикле в клетку переносится по одному иону Na+ и К+ и по два иона Cl–. Так как суммарный заряд при таком переносе ионов равен нулю, скорость транспорта зависит не от мембранного потенциала, а от концентрации этих трех ионов. Суммарный эффект направленных внутрь градиентов Na+ и Cl– и направленного наружу градиента 1C приводит к перемещению всех трех ионов внутрь клетки. Натрий, который входит в клетку и выходит из нее, рециркулирует за счет Nа+,К+-АТФазы. Таким образом, поддерживается высокий градиент Na+ вне клетки. Транспортный белок в этих клетках сходен с белком апикальной мембраны клеток почечных канальцев, переносящих натрий. Фармакологический эффект некоторых диуретиков (фуросемида, буметанида) основан на их влиянии именно на этот белок.
Ионы хлора, которые проникают в клетку через базолатеральные участки мембраны, выходят из клетки через селективные Cl–-каналы в апикальных участках мембраны. Хлор выходит из клетки пассивно. Концентрация Cl– в клетке постоянна и составляет около 30 ммоль/л, в просвете кишки она в три раза меньше, при этом разность потенциалов — около 50-60 мВ. Поэтому при открытии каналов Cl– выходит из клетки (рис. 5-6). Выход Na+ требуемый для компенсации выхода Cl–, происходит преимущественно интерцеллюлярно под действием отрицательного электрического потенциала в просвете кишки. Надо сказать, что активная абсорбция Na+ и активная секреция Cl–, несмотря на разнонаправленный транспорт, создают отрицательный потенциал в просвете кишки (см. подпись к Рис. 5-6). Интересно отметить, что основные механизмы этой секреции встречаются у некоторых позвоночных, но не у млекопитающих, например у акул и птиц, которые имеют так называемые "солевые железы", секретирующие соль.
Цитоплазматическая цАМФ является основным регулятором абсорбции и секреции
Секреция и абсорбция солей — регулируемые процессы, и их нарушение приводит к диарее. Цитоплазматическая циклическая АМФ (цАМФ) является основным фактором в их регуляции. Механизмы, приводящие к повышению концентрации цАМФ в цитоплазме, как правило, усиливают секрецию и снижают абсорбцию солей, приводя к суммарному увеличению секреции. Для понимания этих процессов необходимо описать регулируемые транспортные механизмы (каналы и транспортеры) и компоненты клеточных систем, связанные с цАМФ.
На Рис. 5-7 представлен вторичный мессенджер сигнальной системы (цАМФ), характерный для большинства клеток. Некоторые агонисты, стимулы и фармакологические препараты активируют эту систему, влияя на синтез цАМФ, разрушение цАМФ или на оба этих процесса. Активирующий стимул может взаимодействовать с регуляторным G-белком либо прямо, либо через рецепторы, повышая активность аденилатциклазы, что приводит к увеличению синтеза цАМФ из АТФ. Молекула цАМФ связывается в цитоплазме с регуляторными субъединицами другого фермента (протеинкиназы А), вызывая отщепление активной каталитической субъединицы, которая может катализировать перенос фосфата на клеточные белки.
Наиболее важным механизмом в регуляции внутриклеточных процессов является фосфорилирование, которое имеет значение для транспорта электролитов и воды в кишечнике, в частности в секреторных клетках кишечных крипт. Как показано на Рис. 5-6, любое трансцеллюлярное перемещение Cl– (как поступление хлора через базолатеральные, так и выход хлора через апикальные участки мембраны) регулируется реакцией фосфорилирования. Фосфорилирование апикального Сl–-селективного канала увеличивает время открытия этого канала, а фосфорилирование Na+,K+, 2Cl–-тpaнcпopтнoгo белка усиливает активность этого процесса. Таким образом, любой стимул, увеличивающий содержание в клетке цАМФ, может вызвать резкое усиление активной секреции Cl–.
Роль цАМФ в механизме абсорбции до конца не изучена, хотя есть убедительные данные, говорящие за то, что повышение концентрации цитоплазматической цАМФ уменьшает абсорбцию солей, вероятно, угнетая абсорбцию Na+ и Cl– на апикальном участке мембраны. Суммарный секреторный эффект при повышении концентрации цАМФ усиливается, поскольку, с одной стороны, происходит увеличение секреции, с другой — уменьшение абсорбции. Нет данных о влиянии цАМФ на активность котранспортера Na+ и глюкозы апикального участка мембраны. Поэтому такой путь поступления Na+ в клетку не подавляется даже в случае сильной стимуляции, приводящей к значительному повышению секреции Cl–. Это объясняет эффективность регидратации пероральным приемом растворов глюкозы при лечении диареи.
Циклический гуанозинмонофосфат (цГМФ) также является важным мессенджером в регуляции секреции Cl–. Он образуется под действием гуанилатциклазы и активирует киназу, известную как протеинкиназа G. Циклический ГМФ, как и цАМФ, усиливает секрецию солей, а также ослабляет абсорбцию, хотя тонкие молекулярные основы этих изменений еще менее изучены. Следующим внутриклеточным мессенджером является кальций, который также модулирует абсорбцию и секрецию, хотя механизмы этого действия тоже пока мало изучены.
Cl–-канал апикального участка мембраны является трансмембранным регулятором, "сопровождающим" муковисцидоз
В последние годы резко возрос интерес к белку, функционирующему в качестве хлорного канала в апикальных участках мембраны секреторных клеток тонкой кишки, поскольку при врожденном заболевании — муковисцидозе (кистозном фиброзе) обнаружена мутация гена, кодирующего именно этот белок. Ген кодирует белок , состоящий из 1480 аминокислот и названный муковисцидозным трансмембранным регулятором (cystyc fibrosis transmembrane conductance regulator [CFTR]), который действует в качестве Cl–-селективного ионного канала. Он активируется цАМФ и имеется в клетках поджелудочной железы, кишечника, дыхательных путей, половых органов. Мутация этого гена приводит к нарушению секреции Cl–, что является причиной многих симптомов при муковисцидозе. Нарушение транспорта Cl– может быть прямым следствием дисфункции CFTR Cl–-канала. Мутация может приводить: (1) к образованию неполной цепочки белка, который быстро разрушается в клетке, (2) к синтезу белка с нормальной длиной цепочки, но не встраивающегося в апикальный участок мембраны, (3) к синтезу белка с полной (нормальной) длиной цепочки, но функционально дефектного, который встраивается в апикальный участок мембраны. Наиболее частая мутация — это потеря фенилаланина в положении 508 (ДР508), приводящая к образованию цепочки белка с почти полной длиной, не встраивающейся в мембрану клетки.
Молекулярные механизмы активации CFTR были изучены при анализе его аминокислотного состава (см. Рис. 5-8). Большой цитоплазматический домен (R-домен) содержит много участков, подвергающихся фосфорилированию проте
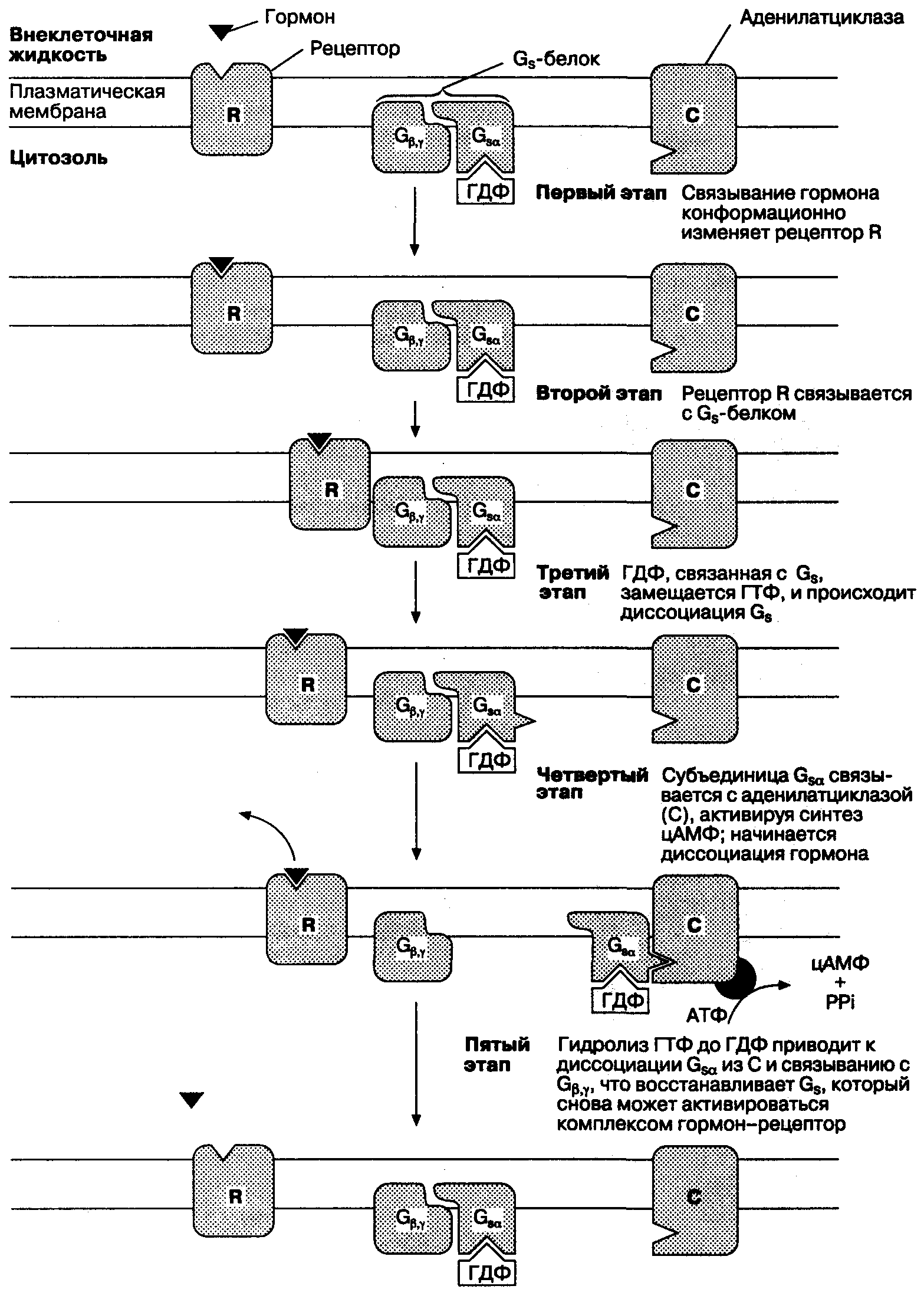
Рис. 5-7. Схема действия вторичного мессенджера сигнальной системы (цАМФ), обнаруженного в большинстве клеток. Связывание гормона (или нейротрансмиттера) с его рецептором образует активированный комплекс, взаимодействующий со стимулирующим G-белком (G;)
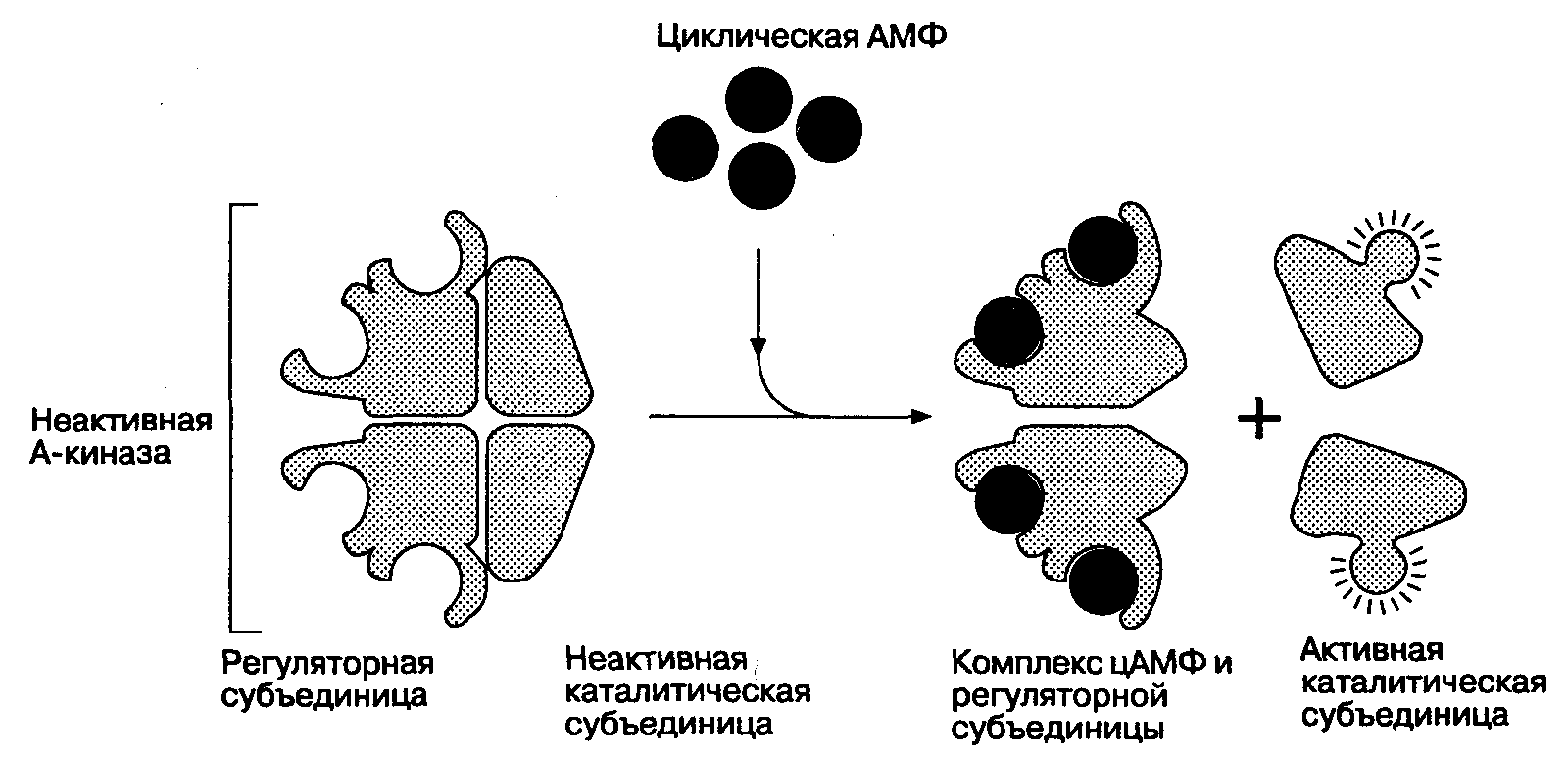
Рис. 5-7 (продолжение). Активированный G-белок освобождается от гуанозиндифосфата (ГДФ), с которым он связан в неактивированном состоянии, и соединяется с гуанозинтрифосфатом (ГТФ). Это приводит к образованию С;д и Gp у-субъединиц, после чего Gsa связывается с аденилатциклазой, которая катализирует образование цАМФ из АТФ. Циклическая АМФ образует связи с регуляторными субъединицами протеинкиназы А, от которой отсоединяются каталитические субъединицы, регулирующие фосфорилирование соответствующих участков белков. (По: DarnellJ., Lodish H., Baltimore D. Molecular Cell Biology, 2nd ed. New York Scientific American Books, W. H. Freeman, 1990.)
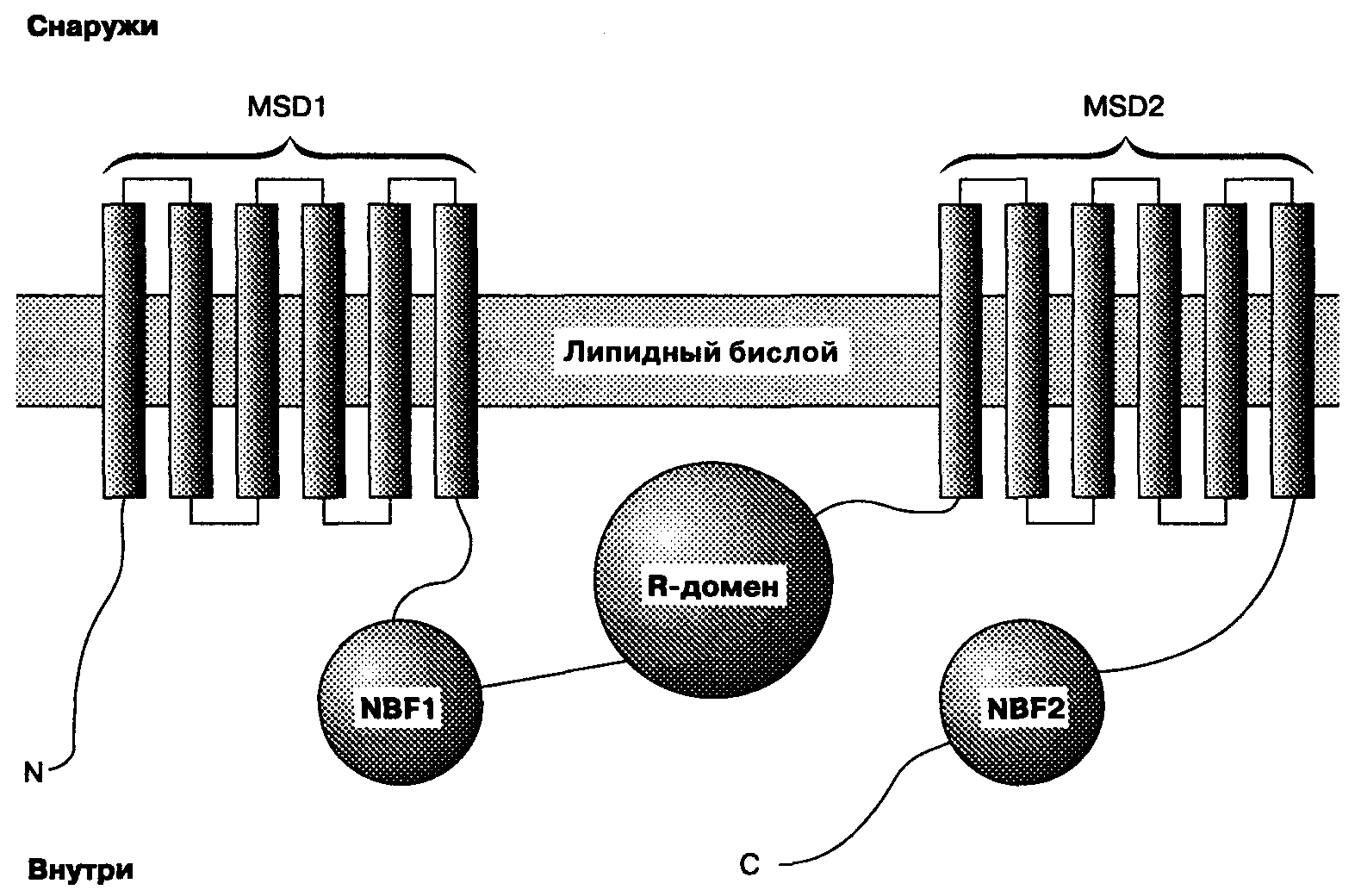
Рис. 5-8. Вероятное строение CFTR. Белок состоит из 1480 аминокислот, образующих около пяти доменов: два мембранно-соединенных домена (MSD1 и MSD2), каждый из которых содержит шесть сегментов, организованных таким образом, что формируют хлорный канал; и три цитоплазматических домена (NBF-1, NBF-2 и R), регулирующих активность канала
инкиназой А (ПКА). Было установлено, что удаление этих участков снижает активность хлорных каналов при повышении концентрации цитоплазматической цАМФ. Эти каналы имеют также два других цитоплазматических регуляторных домена, которые называются нуклеотидсвязывающими, так как они почти гомологичны семейству белков, связывающих и гидролизующих АТФ. Повышение концентрации цАМФ в цитоплазме активирует CFTR следующим образом: цАМФ связывается с каталитической субъединицей протеинкиназы А и освобождает активную каталитическую субъединицу, которая способствует фосфорилированию одной или нескольких сериновых структур R-домена CFTR. Затем нуклеотидсвязывающие участки присоединяют и гидролизуют АТФ, что в результате открывает каналы. Затраты энергии при этом необходимы для изменения конформационной структуры канала, что ведет к его открытию, после чего происходит пассивный транспорт ионов и затрат АТФ для этого процесса не требуется.
В секреторных клетках кишечника CFTR является единственным хлорным каналом, в то время как в секреторных клетках других тканей (дыхательные пути и слюнные железы) имеется еще и кальцийзависимый Сl–-канал в апикальном участке мембраны. Поэтому у больных с муковисцидозом эпителий кишечника не способен секретировать Сl–. Исследования распределения матричной РНК, проведенные с помощью гибридизации клеток показали, что информация для синтеза CFTR реализуется в клетках крипт кишки, где и происходят секреторные процессы.
Энтеротоксины бактерий активируют систему вторичных мессенджеров в клетках
Большинство данных о внутриклеточных механизмах абсорбции и секреции получены при изучении эффектов бактериальных энтеротоксинов, вызывающих тяжелую диарею. Наиболее показательно исследование холерного экзотоксина Vibrio cholerae — инфекции, вызывающей эпидемии в Азии и Южной Америке. Кишечная секреция под действием холерного токсина является следствием длительной активации аденилатциклазы и увеличения концентрации цитоплазматической цАМФ. Экзотоксин представляет собой пептид с массой 84 кД и состоит из одной А и пяти В субъединиц. Субъединица А является простым полипептидом массой 29 кД, в свою очередь, она состоит из двух компонентов — Al (23 кД) и А2 (6 кД), соединенных дисульфидным мостиком. После связывания холерного токсина через свои В субъединицы с поверхностью апикальной мембраны субъединица А проникает в клетку, где высвобождается компонент Al. В цитоплазме он действует как белок, катализирующий ковалентную модификацию G-протеина для активации аденилатциклазы. АДФ-рибоза присоединяется к аргининовому остатку -субъединицы Gs, после чего модифицированная -субъединица отсоединяется от - и -субъединиц и активирует аденилатциклазу, что приводит к повышению цАМФ и стимуляции апикальных Cl–-каналов в секреторных клетках и к снижению активности абсорбирующих клеток. В конечном счете это завершается тяжелой секреторной потерей солей и воды, опасной для жизни. Предполагается, что наличие у больного мутации гена CFTR, вызывающей у гомозигот тяжелые проявления муковисцидоза, у гетерозигот (с потерей только одного гена) сопровождается меньшей чувствительностью к некоторым факторам, способствующим секреторной диарее. Естественными стимуляторами секреции, опосредованными цАМФ, являются секреторные нейротрансмиттеры и, прежде всего, вазоактивный интестинальный полипептид.
Другим важным способом оценки механизмов нарушения секреторного процесса явилось исследование действия термостабильного энтеротоксина Escherichia coli (группа из 18-19-аминокислотных пептидов), активирующего гуанилатциклазу щеточной каемки. Эти секретируемые пептиды связываются с рецепторами гормона гуанидина на апикальном участке мембраны. По-видимому, данные рецепторы сами являются гуанилатциклазой, а связывание с ними стимулирует секрецию и угнетает абсорбцию через механизм цитоплазматической цГМФ.
