- •Тема 4 . Вуглеводні.
- •2.Алгоритм дій , для створення напівструктурної формули за заданою номенклатурною назвою.
- •3.Алгоритм дій для створення ізомерів за заданою формулою.
- •Тема 4 Вуглеводні
- •Vі. Каучуки.
- •Тема4 Вуглеводні
- •Навчальна література:
- •Тема 4 Вуглеводні
- •Написати напівструктурні формули ізомерів
- •6. Розв’яжіть задачі:
- •1.Підготовка до тестової самостійної роботи по темі «вуглеводи».
- •2. Здійснити перетворення:
Тема 4 . Вуглеводні.
Заняття 1.Теорія хімічної будови органічних сполук. Ізомерія. Багатоманітність органічних речовин їх класифікація та номенклатура.
Мета: з’ясувати предмет вивчення органічної хімії, ознайомити студентів з багатоманітністю органічних сполук, поняттям «елементи – органогени», довести єдність живої і неживої природи, розкрити особливості органічних сполук і порівняти з неорганічними; розглянути склад, будову, структурну та електронну формули метану, просторову будову метану , пояснити гібридизацію електронних хмар, вивчити поняття гомології стосовно органічних сполук, вивчити гомологічний ряд, загальну формулу алканів; ознайомитись з основними положеннями теорії Бутлерова, визначити її наукове і практичне значення; ознайомити студентів з фізичними та хімічними властивостями алканів, вивчити правила утворення назв алканів за міжнародною номенклатурою,розглянути взаємний вплив атомів у молекулі на прикладі індукційного ефекту; розглянути явище ізомерії; ознайомитись з способами добування алканів та з галузями застосування даних сполук.
Навчальні питання:
Поняття про органічні сполуки. Елементи – органогени, спільні і відмінні ознаки органічних і неорганічних сполук.
Багатоманітність органічних речовин їх класифікація та номенклатура.
Теорія хімічної будови органічних сполук. Класифікація органічних сполук.
Алкани. Будова , фізичні властивості. Ізомерія. Номенклатурні назви. Хімічні властивості , добування та застосування.
Навчальна література:
Л-3 с. 6-21, 27-30, 31-39
Л-4 с. 49-54
Хід заняття.
Пригадайте з курсу хімії школи , які сполуки називають органічними.( поняття органічна речовина ввів у 1827 році швецький хімік Берцеліус . він визначив органічну хімію ,як хімію сполук тваринного або рослинного походження. В наш час органічна хімія – це хімія сполук Карбону з іншими елементами.)
Які елементи входять до складу органічних сполук.( головні це карбон, гідроген, можуть бути оксисен, нітроген, фосфор, сульфур, галогени, та всі інші елемента періодичної системи)
В якому році було синтезовано першу органічну речовину(1828 – сечовину добув німецький хімік Велер.)
Яка кількість органічних сполук відома в наш час (більше 10 мільйонів сполук).
Чи є чітке розмежування між органічними та неорганічними сполуками (ні , тому , що в неорганічній хімії також вивчаються деякі сполуки карбону – оксиди , карбіди, карбонатна кислота та карбонати.)
ІІІ. Вивчення нового матеріалу.
Органічна хімія – це хімія сполук карбону. Атоми карбону можуть утворювати ланцюжки, кільця , з’єднуватись з іншими атомами. Завдяки цим властивостям карбон може утворювати мільйони різних сполук.
Теорія будови органічних сполук О.М. Бутлерова 1858-1861 роки.
Атоми в молекулі з’єднані не безладно , а в певній послідовності , відповідно до їх валентностей. Карбон в усіх сполуках чотирьохвалентний.
Властивості речовин визначаються не тільки їх якісним та кількісним складом а й їх будовою.
Атоми , або групи атомів у молекулі взаємно впливають один на одного безпосередньо , або через інші атоми.
Будова молекули може бути вивчена на підставі вивчення хімічних властивостей.
Висновок з теорії Бутлерова:
Кожна хімічна органічна сполука повинна мати одну хімічну формулу , що відображає її будову.
Значення теорії:
Ця теорія лежить в основі розуміння хімічних процесів, властивостей речовин, конструювання речовин з заздалегідь визначеними властивостями.
Насичені вуглеводні. Алкани.
Визначення |
Функціо- нальні групи |
Загальна формула |
Номенк- латурна назва |
Види ізомерії |
Будова |
Застосування |
Добування |
Фізичні і Хімічні властивості |
Алкани – насичені вуглеводні з відкритим ланцюгам в молекулах яких атоми карбону зв’язані одинарними зв’язками а всі інші валентності насичені атомами гідрогену. Гомологи – речовини , що мають різну молекулярну формулу , але подібну будову і властивості. Ізомери – речовини, що мають однакову молекулярну формулу , але різні будову і властивості. |
С – С Інших груп немає |
CnH2n+2 |
Нумерація ланцюга починається з того краю , де ближче розгалуження (замісник), закінчення ан.
|
Ізомерія карбонового ланцюга (структурна) |
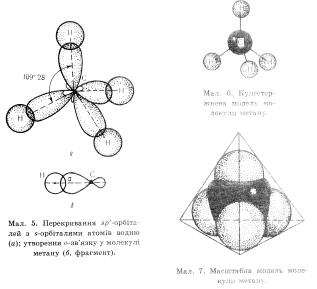
Карбон знаходиться в збудженому стані тому він має валентність чотири.на зовнішньому рівні у карбона є один електрон на s-орбіталі (сферичній), та три на р-орбіталі (гантелеподібній). Під час взаємодії ці орбіталі вирівнюються і набувають однакової форми , розміру та енергії – гібридизуються. Оскільки в даному випадку гібридизуються одна s- та три р-орбіталі, то ця гібридизація називається sр3 Гібридизовані орбіталі в просторі займають таке положення щоб як най далі відштовхуватись одна від одної. Тому вони утворюють тетраедричну піраміду
|
1.як паливо 2.метан використовують для виробництва ацетилену,метилового спирту,формальдегіду 3. окисненням алканів у яких в ланцюзі є 20 – 25 атомів карбону отримують жирні кислоти з яких добувають мило мийні засоби, лаки, емалі, мастила. |
1.в промисловості: 1) природній та супутній нафтові гази, нафта. 2)взаємодія водню та графіту при Т=500 0С С + 2Н2→СН4 3)із синтез газу СО +3Н2→СН4+Н2О 2.в лабораторії 4)реакція Вюрца: 2CH3Cl+2Na →2NaCl+ C2H4 5)карбід алюмінію з водою Al4C3+12H2O→ 4Al(OH)3+3CH4 6)нагрівання суміші натрій ацетату і натрій гідроксиду CH3COONa+NaOH→ CH4+Na2CO3 |
Алкани легші за воду, неполярні тому у воді не розчиняються, від СН4 до С5Н12 – гази, С6Н14 до С15Н32 – рідини, відС16Н34 – тверді речовини. 1.горять СН4+2О2→СО2+2Н2О 2.розклад – (крекінг)це розрив С – С зв’язків під дією температури чи каталізатора. С8Н18→С4Н10+С4Н8 3. дегідрогенування – відщеплення гідрогену.(під дією температури , та каталізатора платини чи пористого заліза) 2СН4→С2Н2+Н2 С2Н6 →С2Н4+Н2 4.Заміщення – реакція характерна для всіх насичених вуглеводнів. Перша стадія відбувається лише під впливом світла CH4+Cl2→CH3Cl +HCl. Всі інші стадії внаслідок індукційного ефекту відбуваються самоплинно. CH3Cl +Cl2→CH3Cl2 +HCl CH2Cl2 +Cl2→CHCl3 +HCl CHCl3 +Cl2→CCl4 +HCl |
Гомологічний ряд алканів |
||||||||
СН4 – метан С2Н6 – етан С3Н8 – пропан С4Н10 – бутан С5Н12 – пентан С6Н14 – гексан С7Н16 – гептан С8Н18 – октан С9Н20 – нонан С10Н22 – декан Кожен наступний член гомологічного ряду відрізняється від попереднього на групу СН2 – що називається гомологічною різницею
|
||||||||
Алгоритм дій для створення номенклатурної назви.
визначити найдовший ланцюг( послідовне з’єднання карбонів), пронумерувати його починаючи з того краю , де ближче замісник. Замісником називається група атомів , що не ввійшла до ланцюга.
С Br
С1 – С2 – С3 – С4 – С5
С
Поставить до кожного атома карбону таку кількість атомів гідрогену , щоб загальна сума зв’язків була рівна чотирьом.
СН3 Br
С1Н3 – С2Н – С3 – С4Н2 – С5Н3
СН3
Назвати замісники. Для створення назви замісника до кореня назви відповідного алкану додається суфікс ил
СН3 – метил F – фтор
С2Н5 – етил Cl – хлор
С3Н7 – пропил Br – бром
С4Н9 – бутил і т.д.
Якщо замісник один то вказується номер атома карбону біля якого стоїть даний замісник і називається сам замісник, якщо є кілька однакових замісників , то спочатку вказуються номера атомів карбону біля яких вони знаходяться , потім за допомогою префікса вказується кількість однакових замісників, потім вказується назва замісника.
Префікси , що вказують кількість однакових замісників:
1 - ----
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
7 – гепта
8 – окта
9 – нона
10 – дека отже, маємо таку назву замісників у нашому прикладі:
СН3 Br
С1Н3 – С2Н – С3 – С4Н2 – С5Н3
СН3
2,3 – диметил – 3 – бром
Після того як ми назвали всі існуючі в молекулі замісники називаємо ланцюг, назва ланцюга - це назва алкану , що має стільки ж атомів карбону, скільки їх є у нашому ланцюзі. В нашому прикладі їх 5 , тому назва нашого ланцюга – пентан.
СН3 Br
С1Н3 – С2Н – С3 – С4Н2 – С5Н3
СН3
2,3 – диметил – 3 – бромпентан.
У назвах органічних сполук цифри , що йдуть послідовно відділяються комами, цифри від слів відділяються дефісом , слова , що йдуть послідовно, пишуться разом.
Самостійна робота студентів.
1.Назвати за міжнародною номенклатурою такі речовини.
 С – С
С
С2Н5
Cl
С – С
С
С2Н5
Cl
С – С – С – С С – С – С – С – С – С – С С – С – С – С – С С – С – С – С – С
С – С С2Н5 С – С – С С С С Cl C