
- •Анализ раствора перекиси водорода 3% 2000мл
- •Анализ концентратов.
- •Анализ раствора магния сульфата 25% - 1000 мл
- •Кальция хлорид 50% 1000 мл
- •Контроль внутриаптечной заготовки.
- •Анализ отдельных лф изготовленных по индивидуальным рецептам
- •Особые требования к изготовлению и контролю качества стерильных растворов.
- •Количественный внутриаптечный контроль раствор Рингера
- •Микстура Звягинцева:
- •Раствор колларгола 3% 10,0
- •Раствор новокаина 2% - 200 мл
Иркутский государственный медицинский университет
Дневник производственной практики по фармацевтическому анализу.
На базе аптеки номер 28 города Ангарск
Осипов Владимир Сергеевич
5 курс фармацевтический факультет
Иркутск 2009
Аптека номер 28 расположена в 206 квартале города Ангарск в доме номер 3. Здание представляет собой отдельную пристройка к жилому с отдельными входами и выходами.
План аптеки представлен на схеме ниже.

В своей работе провизор-аналитик руководствуется приказом номер 1255 от 30.12.1976 года. Он включает:
Должность провизора-аналитика аптеки, замещается лицом с высшим фармацевтическим образованием или другими лицами в порядке, предусмотренном правилами допуска к фармацевтической деятельности.
Назначение и увольнение провизора-аналитика оформляется заведующим аптечным учреждением в установленном порядке.
Провизор-аналитик руководствуется в своей работе действующим законодательством, настоящим Положением, Государственной Фармакопеей, приказами и нормативными документами, утверждаемыми Министерством здравоохранения СССР, Министерством здравоохранения союзной республики и аптечным управлением, а также правилами внутреннего трудового распорядка.
Непосредственная подчиненность провизора-аналитика (заведующему отделом, заместителю заведующего учреждением и т.д.) определяется руководителем аптечного учреждения.
Провизор-аналитик обязан:
проводить изъятие и полный химический анализ приготовленных лекарств, концентратов, полуфабрикатов, скоропортящихся и нестойких препаратов, дистиллированной воды из аптек и аптечных пунктов I группы;
руководить работой подведомственного ему среднего фармацевтического персонала;
владеть всеми видами химического и физико-химического методов анализа в соответствии с требованиями нормативно-технической документации;
в необходимых случаях давать консультации по вопросам хранения, технологии приготовления и контроля лекарств, санитарного режима и другим вопросам, а также по поручению руководителя учреждения (подразделения) осуществлять организационно-методическое руководство по этим вопросам в других учреждениях;
осуществлять контроль за соблюдением технологии приготовления и условий хранения лекарств и медицинских препаратов, сроками хранения концентратов и полуфабрикатов;
о всех случаях ошибок докладывать руководителю или заместителю руководителя учреждения и принимать необходимые меры к их устранению;
вести учет и отчетность по установленным формам.
Провизор-аналитик обязан оказывать первую неотложную медицинскую помощь.
Провизор-аналитик имеет право:
вносить в установленном порядке предложения по вопросам своей компетенции и другим вопросам организации аптечного дела, в том числе о запрещении отпуска из аптечных учреждений непригодных лекарств;
в случае необходимости направлять в установленном порядке на анализ в контрольно-аналитическую лабораторию медицинские препараты, поступившие от поставщиков, и лекарства, приготовленные в аптеке.
Провизор-аналитик обязан систематически повышать уровень своих фармацевтических знаний, внедрять в свою работу прогрессивные методы лекарственного обеспечения населения и научную организацию труда.
П
 ровизор-аналитик
проводит внутриаптечный контроль. Ему
все ЛС изготовленные в аптеках по
индивидуальным рецептам или по требованиям
ЛПУ, а так же внутриаптечная заготовка
подвергается внутриаптечному контролю:
ровизор-аналитик
проводит внутриаптечный контроль. Ему
все ЛС изготовленные в аптеках по
индивидуальным рецептам или по требованиям
ЛПУ, а так же внутриаптечная заготовка
подвергается внутриаптечному контролю:
Письменный. Осуществляется при изготовлении ЛФ как по рецептам, так и по требованиям ЛПУ. Фармацевт по памяти после изготовления заполняет ППК, указывается дата, номер рецепта, название каждого ингредиента на латинском языке, его количество, число доз. Все расчёты до приготовления производятся на оборотной сторон. Изловленные ЛФ, рецепты и паспорта передаются на проверку провизору-технологу. Если ЛС проверил провизор аналитик, то он на паспорте проставляет номер анализа. Хранят паспорт в аптеке 2 месяца.
Органолептический. Проверка внешнего вида, вкуса, цвета, запаха, однородности смешения, отсутствие механических включений. Особое внимание детские. На вкус проверяется внутренние – выборочного.
Опросный. Выборочно после приготовлением фармацевтом не более 5 ЛФ. Провизор-технолог называет первый входящий ингредиент, если сложная ЛФ – его количество, остальные по памяти фармацевт.
Физический. Проверка общей массы, объёма, количества и массы отдельных доз. Нормы отклонений регламентированы приказом МЗ РФ №305 от 16 октября 1997 года. Проверяется каждая серия (3-5 единиц). ЛФ изготовленные по индивидуальным рецепту не менее 3% от ЛФ изготовленных за день. Подвергаются ЛФ подвергающиеся стерилизации до стерилизации. Фиксируется в журнале физического контроля.
Химический. Определение подлинности и количественного анализа. Качественному анализу обязательно подвергается вода очищенная и для инъекций, все медикаменты, поступающие в ассистентскую комнату из отдела запасов. В случае сомнения препараты, поступающие со склада. Внутриаптечная заготовка и фасовка – каждая серия. Качественному контролю выборочно – ЛФ индивидуального изготовления у каждого фармацевта не менее 10% от общего объёма изготовленных ЛС. Особое внимание детским ЛФ, применяемым в глазной практике. ЛС содержащие ядовитые и наркотические препараты. Качественному и количественному подвергается обязательно растворы для инъекций и инфузий до, и после стерилизации, стерильные растворы для наружного применения, глазные капли и мази, содержащие наркотические и ядовитые вещества, все ЛФ для новорожденных, растворы атропина сульфата, HCl для внутреннего применения, растворы нитрата серебра, вся внутриаптечная заготовка – каждая серия, стабилизаторы для инъекционных растворов и глазных капель, концентрация этилового спирта при разведении, детские инъекционные. Выборочно ЛФ изготавливаемых индивидуально по рецептам или требованиям не менее 3 в 1 смену с учётом всех видов ЛФ. Особое внимание для детских лекарств, глазных, для содержащих ядовитые и наркотические.
контроль при отпуске. Все ЛФ. Проверяется соответствие упаковке ЛФ химическим свойствам. Правильное оформление ЛФ – инструктивное письмо МЗ РФ от 4 июля 1997 года «Единые правила оформления лекарств изготавливаемых в аптечных учреждениях различных форм собственности». Проверка указанных в рецепте доз возрасту больного. Соответствие номера на рецепте и на этикетке фамилии больного, обращается внимание на необходимые предупредительные надписи.
Рабочее место провизора-аналитика
Провизор-аналитик работает за столом ассистентским сборно-секционным. Он состоит из стандартных секций, основанием которых является разборный металлический трубчатый каркас. Под крышкой стола подвешены выдвижные ящики с секциями и сборники для жидких отходов, выполненных из реактивоустойчевых устойчивых сортов пластмасс. На столе монтируется штепсельная розетка.
На столе имеется вертушка настольная и напольная для реактивов, используемых для проведения анализов. Имеется так же установка для титрования, устройство для подвода дистиллированной воды. Под столом имеется шкафчик для хранения журналов, справочной литературы, бланков документов, бумаги, колб для титрования. На столе имеется штатив в котором имеются пенициллиновые флаконы для титрования, так же штатив для хранения пипеток. Так же имеется рефрактометр и рН-метр. Имеется лампа для освещения рабочей поверхности стола.
Провизор аналитик ведёт журналы:
журнал регистрации контроля воды очищенной и воды для инъкций
журнал регистрации полного химического контроля лекарственных форм для инъекций
журнал регистрации результатов органолептического, физического и химического контроля, внутриаптечной заготовки, лекарственных форм изготовленных по индивидуальным рецептам, требованиям ЛПУ, концентратов, полуфабрикатов, тритураций, спирта этилового, фасовки.
Журнал регистрации результатов контроля ЛС на подлинность.
Из справочной литературы имеется
Сборник нормативных актов по контролю качества и технологии изготовления ЛС в аптечных организациях.
методические рекомендации по анализу ЛФ изготовленных в аптеке
государственная фармакопея 10 и 11 издания
справочники фармацевта
учебные пособия по технологии ЛФ
Вода очищенная
Получение и хранение воды очищенной производится в специально оборудованном для этой цели помещении. Получение воды для инъекций осуществляется в помещении дистилляционной асептического блока, где выполняются работы, связанные только с перегонкой воды.
Воду очищенную используют свежеприготовленной или хранят в закрытых емкостях, изготовленных из материалов, не изменяющих свойства воды и защищающих ее от инородных частиц и микробиологических загрязнений, не более 3 суток.
Воду для инъекций используют свежеприготовленной или хранят при температуре от 5˚ С до 10˚ С или от 80˚ С до 95˚ С в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды, защищающих ее от попадания механических включений и микробиологических загрязнений, не более 24 часов.
Вода очищенная, вода для инъекций ежедневно проверяется на отсутствие хлоридов, сульфатов и солей кальция. Вода, предназначенная для изготовления стерильных растворов, кроме указанных выше испытаний должна быть проверена на отсутствие восстанавливающих веществ, солей аммония и углерода диоксида в соответствии с требованиями действующей Государственной Фармакопеи.
Ежеквартально вода очищенная должна направляться в территориальную контрольно - аналитическую лабораторию для полного химического анализа.
Определение хлоридов:
К 10 мл воды прибавляют 0,5 мл разведённой азотной кислоты, делят на 2-е равные части. К одной из них прибавляют 0,5 мл 2% нитрата серебра и оба раствора сравнивают между собой через 5 минут. Не должно быть различий.
![]()
Определение сульфатов:
К 10 мл воды прибавляют 0,5 мл разведённой соляной кислоты, делят на 2-е равные части. К одной из частей прибавляют 1 мл хлорида бария и сравнивают через 10 минут. Не должно быть различий.
![]()
Определение кальция:
К 10 мл воды прибавляют 1 мл хлорида аммония 1 мл аммиака, делят на 2-е равнее части. К одной из частей прибавляют 1 мл оксалата аммония и оба раствора сравнивают через 10 минут. Не должно быть различий.
![]()
Определение восстанавливающих веществ:
100 мл воды доводят до кипения и прибавляют 1 мл 0,01 Н перманганата калия и 2 мл разведённой серной кислоты, кипятят 10 минут. Розовая окраска должна сохраниться.
![]()
Определение аммиака:
К 10 мл воды прибавляют 0,2 мл реактива Неслера, перемешивают и через 5 минут сравнивают с эталоном, состоящим из 1 мл эталона Б, разведённого водой до 10 мл и такого же количества реактива. Окраска не должна превышать эталон.
![]()
Определение диоксида углерода:
5 мл воды смешивают с 5 мл известковой воды, взбалтывают в хорошо закрытом сосуде. Не должно быть мути в течение часа.
![]()
Приемочный контроль
Приемочный контроль проводится с целью предупреждения поступления в аптеку некачественных лекарственных средств. Приемочный контроль заключается в проверке поступающих лекарственных средств на соответствие требованиям по показателям: "Описание"; "Упаковка"; "Маркировка"; в проверке правильности оформления расчетных документов (счетов), а также наличия сертификатов соответствия производителя и других документов, подтверждающих качество лекарственных средств в соответствии с действующими нормативными документами.
Контроль по показателю "Описание" включает проверку внешнего вида, цвета, запаха. В случае сомнения в качестве лекарственных средств образцы направляются в территориальную контрольно - аналитическую лабораторию. Такие лекарственные средства с обозначением: "Забраковано при приемочном контроле" хранятся в аптеке изолированно от других лекарственных средств.
При проверке по показателю "Упаковка" особое внимание обращается на ее целостность и соответствие физико-химическим свойствам лекарственных средств.
При контроле по показателю "Маркировка" обращается внимание на соответствие оформления лекарственных средств действующим требованиям. Особое внимание следует обращать на соответствие маркировки первичной, вторичной и групповой упаковки, наличие листовки - вкладыша на русском языке в упаковке (или отдельно в пачке на все количество готовых лекарственных средств). На этикетках упаковки с лекарственными веществами, предназначенными для изготовления растворов для инъекций и инфузий, должно быть указание "Годен для инъекций". Упаковки с ядовитыми и наркотическими лекарственными средствами должны быть оформлены в соответствии с требованиями законодательства Российской Федерации и нормативных документов.
Анализ скоропортящихся и нестойких препаратов.
Анализ нашатырно-анисовых капель
Подлинность
органолептическое определение по характерному запаху анисового масла и аммиака
0,5 мл препарата с 5 мл воды образует характерную молочно-мутную жидкость щелочной реакции
к 2 каплям препарата прибавляют 1 каплю реактива Неслера. Появляется красно-бурый осадок.
Количественное определение
Определяют ацидиметрическим методом титрования с индикатором метиловым красным.
![]()

Методика: к 0,5мл препарата прибавляют 10 мл воды и 2-3 капли раствора метиленового красного и титруют 0,1н раствором соляной кислоты до красного окрашивания.

Должно быть 1,42-1,58% аммиака
Анализ раствора перекиси водорода 3% 2000мл
На анализ можно взять 20 мл (1% от 2000мл) согласно приказу 305.
Подлинность
К 1мл препарата прибавляют 0,2 мл разведённой серной кислоты, 2 мл эфира, 0,2 мл раствора бихромата калия и взбалтывают. Эфирный слой окрашивается в синий цвет.
Количественное определение.
Метод перманганатометрия.
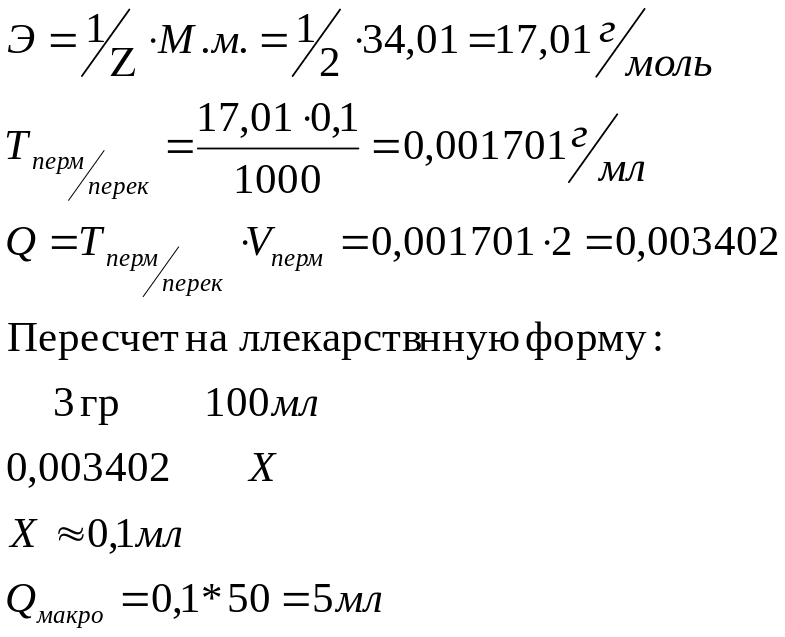
Используем разведение в 50 раз
Методика: в мерную колбу на 50 мл помещаем 1 мл препарата, доводим водой до метки, на анализ берём 1 мл. К 0,5 мл препарата прибавляют по 3 мл воды, серной кислоты и титруют 0,1н раствором перманганата калия до слабого розового окрашивания.

Должно быть 2,7-3,3%
ЛФ соответствует прописи
Анализ концентратов.
Концентрированные растворы – растворы ЛВ большей концентрации, чем эти вещества прописываются в рецептах. Используются для приготовления ЛФ.
Приказом 214 в приложении регламентируется перечень концентратов изготовляемых в аптеке, а так же сроки их хранения в аптеке, а для особо нестабильных ещё дополнительные условия хранения. В соответствии с приказом 214 концентрации подлежат:
подлежат обязательному качественному контролю.
качественному и количественному контролю подлежат после приготовления
Использование:
упрощается и ускоряется процедура выполнения ЛФ
операции отвешивания ЛВ, отмеривание растворителя, растворение, фильтрация заменяются отмериванием концентрированного раствора)
повышается уровень качества приготовленных ЛВ
при приготовлении концентратов используются большие навески ЛП,
большие объёмы растворителя при этом снижается ошибка,
концентраты готовятся в асептических условиях
повышается уровень контроля качества
контролируется каждая серия концентрированного раствора,
можно использовать полумикровариант при анализе (можно не экономить анализируемый раствор),
при утверждении номенклатуры концентратов в аптеке предварительно разрабатывается методика контроля, которая подтверждается расчётами и предварительно утверждается в КАЛ,
результаты контроля регистрируются в специальном журнале, который предусматривает подпись не только приготовившего раствор, но и проверившего его).
Анализ концентратов предполагает экспресность. Она обеспечивается использованием в анализе наиболее простых методов, предварительным составлением расчётных таблиц.
Расчёты ведут по приказу 435.
Анализ раствора магния сульфата 25% - 1000 мл
Качественный анализ:
Внешний вид раствора:
Прозрачная, бесцветная жидкость.
Магний

0,144 мл концентрата – открываемый минимум. Для удобства возьмём 1 мл, в одном мл 0,25 магния.
К 1 мл раствора магния сульфата 25% прибавляют 1 мл раствора хлорида аммония, 1 мл раствора аммиака и 0,5 мл раствора фосфата натрия; образовался белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте.
Сульфаты

0,28 мл концентрата – открываемый минимум. Для удобства возьмём 1 мл, в одном мл 0,25 сульфатов
К 2 мл раствора сульфата (0,005-0,05 г иона сульфата) прибавляют 0,5 мл раствора хлорида бария; образовался белый осадок, нерастворимый в разведенных минеральных кислотах.
Количественное определение:
Метод - комплексонометрия

Концентрация раствора выше 3% - его предварительно разбавляют, например в 25 раз.
1мл*25=25мл (Qмакро)
Условия разведения – объём мерной колбы 250 мл; объём разведения 1/25 от 250 – 10 мл
Методика: 25 мл концентрата помещаем в мерную колбу на 250 мл и доводим водой до метки. В колбу для титрования помещаем 10 мл раствора из мерной колбы, добавляем 4мл аммиачного буфера 10 капель кислотного хрома темно-синего и титруем 0,1М раствором ЭДТА до сине-фиолетового окрашивания.
Расчёт фактора.

Расчёт допустимого предела расхода титранта
25гр МС – 100мл раствора
Х – 25мл – Qмакро
Х=6,25гр
6,25гр – 250мл
Х – 10мл
Х=0,25
В соответствии с приказом номер 305 допустимое отклонение 1%
0,25гр ±1%=
0,25 – 100
Х – 1
Х=0,005
0,25±0,0025
Нижний предел содержания 0,2475 0,2475/0,02464=10 мл титранта
Верхний предел содержания 0,2525 0,2525/0,02464=10,24 мл титранта
На титрование пошло 10 мл – концентрация раствора ответствует прописи
